buozmoz ve çözücü geçişi, daha az konsantre bir çözeltiden daha konsantre bir çözeltiye, yarı geçirgen zar, çözeltinin membrana uyguladığı basınç çözücünün geçişini engelleyene kadar. Bu süreç, amaçlanan Çözeltinin konsantrasyonunu dengeleyin.
sen de oku: Çözünen ve çözücü
ozmotik basınç
bu ozmotik basınç ve daha yüksek konsantrasyonda çözeltiye uygulanan basınç böylece ozmoz oluşmaz, yani çözücü yarı geçirgen zardan geçmez.
Ozmotik basınç proseslerde kullanılır. Suyun tuzdan arındırılmasısürecini zorlayarak ters osmoz, çözücünün daha konsantre çözeltiden daha az konsantre olana geçmesine neden olur. Biz bu süreci ters osmoz. İki işlemi karşılaştıran aşağıdaki resme bakın:
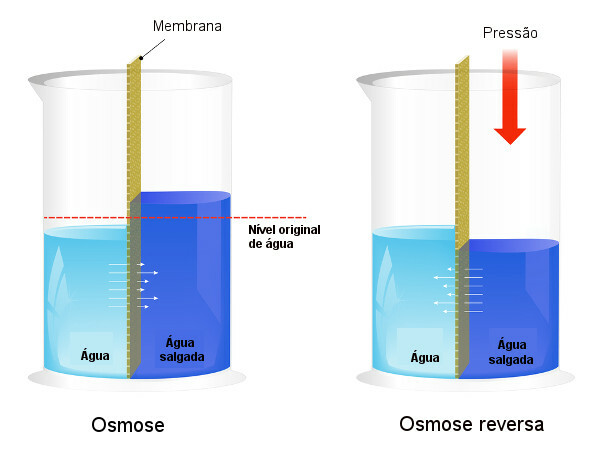
Ozmozda çözücü geçişinin en konsantre çözelti yönünde olduğuna ve ters osmozda geçişin uygulanan basınç nedeniyle ters yönde olduğuna dikkat edin. Konu hakkında daha fazla bilgi edinmek için metnimizi okuyun: ozmotik basınç.
daha fazlasını bil: Deniz suyunun tuzdan arındırılmasında ters ozmoz
Şimdi durma... Reklamdan sonra devamı var ;)
ozmotik basınç denklemi
Harf ile temsil edilen ozmotik basınç pi (π) bir çözüm, aşağıdaki denklemle hesaplanabilir:
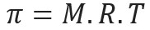
M = mol/L cinsinden konsantrasyon
R = mükemmel gazların evrensel sabiti
T = mutlak sıcaklık, K cinsinden
diğerleri gibi kolligatif özellikler, ozmotik basınç bağlıdır çözelti konsantrasyonuyani, çözeltinin konsantrasyonu ne kadar büyük olursa, ozmozun çözeltiler üzerindeki etkisi o kadar büyük olur ve bu nedenle ozmotik basınç o kadar büyük olur.
Örnekler
Osmoz günlük hayatımızda farklı zamanlarda ortaya çıkar. örneğini aktarabiliriz et tuzlama işlemi senin için koruma. Sen mikroorganizmalar etin bozulmasına neden olur su kaybetmekiçeriden dışarıya, bir tuz konsantrasyonuna sahip olan, yiyeceğin daha uzun süre dayanmasını sağlar.
Tuz nedeniyle, aynı zamanda olur bir salatanın yaprakları soluyor içlerinden su kaybetmek için hücreler (bir tür daha az konsantre) için temperli çözelti dış ortamda.
Osmoz hakkında konuştuğumuzda da önemlidir kan insan. diyoruz ki Kırmızı hücreler ve kan birdir izotonik ortamyani aynı ozmotik basınca sahip olduklarından, suyun hücreye kolaylıkla giriş ve çıkışını sağlarlar.
Bununla birlikte, kan kırmızı kan hücrelerinin içindekinden daha az konsantre hale geldiğinde (hipotonik ortam), suyun hücre içinde geçişi daha kolay gerçekleşir, bu da onu patlayana kadar şişmek. Kan, kırmızı hücre konsantrasyonundan (hipertonik ortam) daha yüksek bir konsantrasyona ulaşırsa, kan hücreleri kurur, su kaybettikleri için.

Aynı et koruma ilkesine göre, meyve korumaşeker kompostosunedeniyle yiyecekleri koruyanlar yüksek şeker konsantrasyonu çözümde.
Aşağıdakiler ozmozun meydana geldiği diğer örneklerdir:
- bitkinin iletken damarlarında özsu artışında;
- hemodiyaliz;
- insan vücudunun hücrelerinde besinlerin seçici geçişinde.
Hayvan hücresinde, bitki hücresinde ve diğer biyolojik konularda ozmozun nasıl gerçekleştiğini anlamak için şunları okuyun: Osmoz: Ne olduğu ve hayvan ve bitki hücresinde nasıl meydana geldiği.
Victor Ferreira tarafından
Kimya hocası
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
FERREIRA, Victor Ricardo. "Osmoz"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/osmose.htm. 28 Haziran 2021'de erişildi.


