atbazlar Suya eklendiklerinde tek anyon olarak salma özelliğine sahip maddelerdir. hidroksit, oh-1. Sudayken, bazlar fenomeninden muzdariptir. ayrışmasulu bir ortamda iyonların serbest bırakılmasıdır. Belirli bir bazın salacağı anyon miktarı, bazın suda çözünme kabiliyeti ile ilgilidir.
Bu nedenle, bilmek çok önemlidir çözünürlük bazın suda birçok iyonu serbest bırakıp bırakamayacağını, yani iyi olup olmayacağını tahmin etmek için suda sunduğu elektrolit (iyonize veya ayrışabilen madde). Bazların çözünürlüğü hakkında bilgi, genellikle nasıl kullanılacağını veya kullanılacağını belirler. Örneğin:
Sodyum hidroksit (NaOH), son derece çözünür bir baz olduğu için antasit olarak kullanılamaz. çok güçlü taban.
Alüminyum hidroksit [Al(OH)3] bir antasit olarak kullanılabilir, çünkü pratik olarak çözünmez bir bazdır ve bu onu bir zayıf taban.
Not: Taban ne kadar güçlü olursa, korozyon gücü o kadar yüksek olur. Bu nedenle kişinin sindirim sistemine zarar vermemek için güçlü bir bazları antasit olarak kullanmıyoruz.

Suda çözülen baz
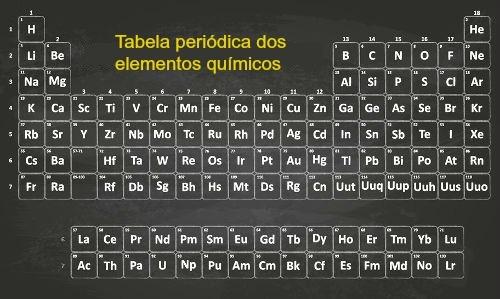
Bir bazın çözünürlüğünü belirlemek için kimyasal formülünü değerlendirmek ve periyodik tabloyla karşılaştırmak yeterlidir. Eşlik eden kimyasal element hidroksil (OH), çözünürlük açısından sahip olduğumuz bazın türünü belirleyecek olandır. Çözünürlük için temel sınıflandırmalar şunlardır:
Şimdi durma... Reklamdan sonra devamı var ;)
a) Çözünür bazlar
Bunlar kimyasal elementlerin oluşturduğu bazlardır. alkali metaller (ailede mevcut IA), ancak bu kuralın amonyum hidroksit (NH) olan bir istisnası vardır.4OH). Çözünür bazlara örnekler:
LiOH (lityum hidroksit)
NaOH (Sodyum hidroksit)
KOH (Potasyum hidroksit)
b) Az çözünür bazlar
Bunlar kimyasal elementlerin oluşturduğu bazlardır. alkali metaller dünyevi (ailede mevcut IIA). Az çözünür bazlara örnekler:
Bay (OH)2 (stronsiyum hidroksit) - pancar şekerinin rafinasyonunda kullanılır.
Ca(OH)2 (Kalsiyum hidroksit) - inşaatlarda kullanılır.
Not: Magnezyum [MgOH) tarafından oluşturulan bazlar2] ve berilyum [Be (OH) ile2Alkali metaller olan ], o kadar düşük çözünürlüğe sahiptir ki, pratik olarak çözünmez olarak kabul edilirler.
c) Pratik olarak çözünmeyen bazlar
Bileşimlerinde alkali metal veya toprak alkali metal elementleri bulunmayan bazlardır. Pratik olarak çözünmeyen bazların örnekleri.
Ni(OH)2 (Nikel hidroksit II) – pillerde bulunur
Fe(OH)3 (Demir hidroksit III) - kahverengi pigment olarak kullanılır
Cu(OH)2 (bakır hidroksit II) - mantar ilacı olarak kullanılır
Not: Metindeki kuvvetlerini belirlemeyi öğrenerek bazların çözünürlüğü konusundaki çalışmanızı tamamlayın. Bazlardan ayrılma gücü veya derecesi.
Benden Diogo Lopes Dias
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
GÜNLER, Diogo Lopes. "Bazların çözünürlüğü"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/solubilidade-das-bases.htm. 28 Haziran 2021'de erişildi.
Baz İsimlendirme, Sulu Çözelti, İyonik Ayrışma, Katyon, Anyon, Sodyum Hidroksit, Alüminyum Hidroksit, Demir Hidroksit, Bakır Hidroksit, Ferrik Hidroksit, Kalsiyum Hidroksit.