Termodinamiğin Birinci Yasasına göre, herhangi bir termodinamik süreçte ısı miktarı S Bir sistem tarafından alınan, sistem tarafından yapılan işe ve iç enerjisinin değişimine eşittir.
Basınç sabit olduğunda, sistemin dış ortamla değiştirdiği ısı, iş için ve iç enerjiyi değiştirmek için kullanılır. Pek çok pratik durumda sistemler, kimyasal reaksiyon durumunda olduğu gibi atmosfer basıncına maruz kalır. Yukarıdaki şekil, bu tür bir işlemin PV diyagramını göstermektedir.
Bu durumda, Birinci Kanun denkleminde,
Q=τ+∆U
terimlerin hiçbiri sıfır değildir. Çalışma, hacim değişimi hacminin bir fonksiyonu olarak yazılmıştır, örneğin:
τ=P.∆V
İdeal bir tek atomlu gazın özel durumu için enerji aşağıdaki gibi yazılabilir:
Şimdi durma... Reklamdan sonra devamı var ;)

Bu nedenle, Termodinamiğin Birinci Yasasını ΔV'nin bir fonksiyonu olarak yazabiliriz:


Ortamla değiştirilen ısı (5/2)P.ΔV'dir ve toplamın %40'ı – P.ΔV'ye karşılık gelir – iş yapmak için kullanılır; ve toplamın %60'ına tekabül eden (3/2)P.ΔV, iç enerjiyi değiştirmek için kullanılır. Bu sonuç ideal bir monoatomik gaz için geçerlidir.
Isı (ideal gaz yasasını kullanarak) sıcaklık değişimi ile ilgilidir:
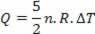
Böylece verilen ısı, sıcaklıktaki değişiklikle veya hacimdeki değişiklikle hesaplanabilir.
Domitiano Marques tarafından
Fizik Mezunu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
SILVA, Domitiano Correa Marques da. "İzobarik süreçler için birinci yasa"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm. 27 Haziran 2021'de erişildi.