bu oto-oksi-redüksiyon veya orantısız reaksiyon aynı kimyasal elementin geçtiği bir tür redoks reaksiyonudur. oksidasyon ve azaltma. Bu tür reaksiyonların iki örneğine ve redoks yöntemini kullanarak bunların nasıl dengeleneceğine bakalım:
1. Örnek:
ŞEHİR2- + H+ → HAYIR3- + HAYIR + H2Ö
- Reaksiyona dahil olan tüm atomların ve iyonların oksidasyon numaralarını (NOX) hesaplayarak, kimin oksitlendiğini ve kimin reaksiyona girdiğini doğrulamak mümkündür:
+3 -2 +1 +5 -2 +2 -2 +1 -2
ŞEHİR2- + H+ → HAYIR3- + HAYIR + H2Ö
- Azotun hem reaksiyona giren hem de oksitlenen tür olduğuna dikkat edin:
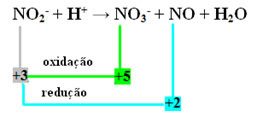
- Bu reaksiyonun redoks dengelemesini gerçekleştirmek için, NOX'i reaktiflerle değil, ürünlerle ilişkilendirmemiz gerekir:
ŞEHİR3- =∆Nox = 5 - 3 = 2
NO=∆Nox = 3 - 2 = 1
- ∆NOX'u katsayılarla tersine çevirerek şunları elde ederiz:
ŞEHİR3- =∆NOX= 2 → 2 NO katsayısı olacak
HAYIR=∆NOX= 1→ 1 NO katsayısı olacak3-
ŞEHİR2- + H+ → 1 ŞEHİR3- + 2 HAYIR+H2Ö
- Bununla, üründe 3 N olduğunu zaten biliyoruz, bu nedenle NO katsayısı2- 3 olacak:
3 HAYIR2- + H+ → 1 HAYIR3- + 2 HAYIR + H2Ö
- H katsayılarını belirlemek için+ ve H'den2O, alınan elektronların sayısının bağışlanan elektronların aynı miktarına eşit olduğunu unutmayın; bu nedenle, reaktif yükü ürün yüküne eşit olacaktır. Bu şekilde aşağıdaki şemayı yapabiliriz:
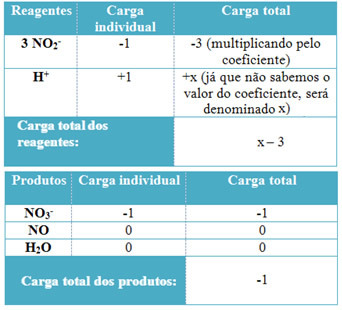
Şimdi durma... Reklamdan sonra devamı var ;)
Bu bilgilere dayanarak, reaktiflerin toplam yükünün şuna eşit olduğunu elde ederiz: x – 3 ve ürün eşittir -1. Belirtildiği gibi, ikisinin ücretleri eşit olmalıdır. Zaten toplam ürün yüküne sahip olduğumuz için, x'in değerinin ne olacağını bilmek için basit bir hesaplama yapabiliriz:
x -3 = -1
x = -1 +3
x = 2
Böylece, H katsayısı+ 2'dir ve dolayısıyla H'ninki21 olacak:
3 HAYIR2- + 2 Saat+ → 1 HAYIR3- + 2 HAYIR + 1 H2Ö
2. Örnek:
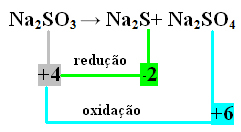
Bu durumda, aynı anda indirgeme ve oksidasyona maruz kalan S idi. Böylece, daha önce yapıldığı gibi, NOX'i ürünlerle ilişkilendirebilir ve katsayıları atayarak değerlerini tersine çevirebiliriz:
at2 S=∆Nox = 4 – (-2) = 6 → 6 Na katsayısı olacak2 SADECE4
at2 SADECE4=∆Nox = 6 - 4 = 2 → 2 Na katsayısı olacak2 s
at2 SADECE3→ 2 at2 E+ 6 at2 SADECE4
2. kolda 8 kükürt olduğu için Na katsayısı2 SADECE3 8 olacak:
8 İçinde2 SADECE3→ 2 Giriş2 S + 6 In2 SADECE4
Jennifer Foğaça tarafından
Kimya mezunu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
FOGAÇA, Jennifer Rocha Vargas. "Kendini oksitleyen reaksiyonlar"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm. 28 Haziran 2021'de erişildi.