asitler maddelerdir sulu ortamda iyonize ve iyiler iletkenler güç. Bir maddenin asitliği, hidrojen iyonik potansiyelini ölçmek için tekniklerle ölçülebilir (pH) bir çözüm. Bazı pH analitik yöntemleri, çözeltinin pH değerini renkli olarak yansıtan turnusol veya fenolftalein gibi göstergeler kullanır.
Asitler karakterize edilebilir:
molekülünde oksijen bulunup bulunmadığına göre;
zorla;
iyonlaşabilir hidrojenler tarafından;
oynaklığı sayesinde.
Siz de okuyun:Asitler ve bazlar arasındaki karşılaştırma - farklılıklar ve özellikler
Asitlerin özellikleri
Sulu bir ortamda iyonlaşarak H katyonunu serbest bırakırlar.+.
açığa çıkması nedeniyle elektriği iletirler. iyonlar sulu bir ortamda.
Temel çevre ile temas halinde, acı çekerler. Nötrleştirme reaksiyonu, bu reaksiyonun ürünleri olarak tuz ve su oluşturur.
Turnusol veya fenolftalein gibi bir indikatör maddenin varlığında çözeltinin rengini değiştirirler.
Limon, portakal ve diğer turunçgillerin ekşi tadı, bu gıdalarda bulunan asitten kaynaklanmaktadır.
Hidrojen potansiyeli (pH)
Hidrojen iyon potansiyeli (pH), aşağıdakileri ifade eden bir hesaplamadır. iyon konsantrasyonu hidrojen belirli bir şekilde çözüm. pH'ı belirlemek ve ortamı analiz etmek için aşağıdakiler dikkate alınır:
Ostwald'ın seyreltme yasası (daha fazla seyreltilmiş, çözeltide daha fazla iyon oluşacaktır);
H molekülünün doğal parçalanması olan su otoiyonizasyonu (Kw)2H iyonlarında O+ ve oh-;
25°C'de damıtılmış su otoiyonizasyona sahiptir Kw = 10-14 ve aynı konsantrasyonda H iyonları+ ve oh-yani nötr bir ortamdır.
H konsantrasyonu içeren pH hesaplaması için+, kullanın: pH = -log[H+].
Biliyorum:
pH > 7 → bazik çözelti
pH < 7 → asidik çözelti
pH = 7 veya pH = pOH → nötr çözelti
Ayrıca bakınız: Asit formülleri nasıldır?

Asitlerin sınıflandırılması
bu asit sınıflandırması dört farklı kriter dikkate alınarak yapılabilir.
İyonizasyon derecesi (α) veya asit gücü
α = iyonize molekül sayısı
çözünmüş molekül sayısı
Güçlü asitler: α ≥ 50%.
Misal: áasit sülfürik (H2SADECE4) → α = 61%.Yarı güçlü veya orta asitler: 5% < α < 50%.
Misal: fosforik asit (H3TOZ4) → α = 27%.Zayıf asitler: α ≤ 5%.
Misal: borik asit (H3BÖ3) → α = 0,075%.
→ İyonize olabilen hidrojen sayısı
monoasit: bir H katyonu salıverir+.
Misal: áasit hidroklorik (HCL);
diasit: iki H katyonunu serbest bırakır+.
Misal: hidrojen sülfür (H2S).triasit: üç H katyonunu serbest bırakır+.
Misal: borik asit (H3BÖ3).tetrasit: dört H katyonunu serbest bırakır+.
Misal: pirofosforik asit (H4P2Ö7).
Dikkat! Hidrasitler söz konusu olduğunda, moleküldeki tüm hidrojenler iyonlaşabilir; ancak oksiasitler söz konusu olduğunda, yalnızca bir oksijen atomuna bağlı hidrojenler iyonlaşabilir. Bir örnek hipofosfor asittir (H3TOZ2), bir monoasittir, çünkü bileşiminde üç hidrojen olmasına rağmen, sadece bağlı olan hidrojeni serbest bırakır. oksijen.
→ Oksijen varlığı
oksiasitler: yapısında oksijen bulunur.
Misal: hipokloröz asit (H2O Cl).
Hidrasitler: yapılarında oksijen yoktur.
Misal: hidroflorik asit (HF).
→ Oynaklık
Sabit: kaynama noktası(AYAK) > 100°C, yavaş yavaş gaz haline dönüşüyor.
Misal: sülfürik asit (H2SADECE4) → PE = 340 °C.uçucular: kaynama noktası < 100°C, hızlı ve kolay bir şekilde gaz haline dönüşüyor.
Misal: hidrojen sülfür (H2S) → PE = -59.6°C.
asit terminolojisi
→ Hidrasitler
Asit + anyon adı + hidrik
Tüm asitler için, molekülü karakterize eden isimlendirmeden önce "asit" terimi kullanılır. Hidrasitlerde element adının “eto” son eki “hidrik” ile değiştirilir.
Örnekler:
HCl → asit klorhidrolik
HBr → asit bromhidrolik
HF → asit florhidrolik
→ oksiasitler
Oksiasitlerin isimlendirilmesi, oksiasitlerin isimlendirilmesine göre değişir. oksidasyon numarası (NOX) merkezi unsurdan. Aşağıdaki tabloya bakın:
merkezi elemanın NOX'i |
asit terminolojisi |
||
önek- |
-infix- |
-sonek |
|
+1 ve +2 |
su aygırı |
-anyon adı- |
-oso |
+3 ve +4 |
-- |
anyon adı- |
-oso |
+5 ve +6 |
-- |
anyon adı- |
-ic |
+7 |
Başına |
-anyon adı- |
-ic |
Örnekler:
HClO → Hidrojenin (H) normalde NOX +1'e ve oksijenin (O) NOX -2'ye sahip olduğunu bilerek, 0 yüklü bir moleküle sahip olmamız için klorin (Cl) NOX +1'e sahip olmalıdır, bu nedenle bu asidin adlandırılması şöyledir: hipokloröz asit.
HNO2 → nitröz asit
HClO4 →áasitperklorik
→ Kuralın istisnaları
H2CO3 → karbonik asit, ve NOX kuralı altında olacağı gibi karbonlu değil.
H3BÖ3 → áasit borik, ve sıkıcı değil.
Günlük yaşamda asitler
Gübreler ve İlaçlar: Fosforik asit (H3TOZ4) gübre üretiminde ve ayrıca ilaç olarak yaygın olarak kullanılmaktadır. Farmasötik alanda kullanılan birkaç asitten biridir.
Turunçgiller: askorbik asit (C6H8Ö6), Ayrıca şöyle bilinir C vitamini.
Sirke: bileşiminde vardır Asetik asit (CH3COOH).
- Maden suyu ve alkolsüz içecekler: karbonik asitten (H2CO3), ürüne ferahlatıcı bir his verir.
Ayrıca erişim:Alkolsüz içeceklerde asitlerin rolü

çözülmüş alıştırmalar
Soru 1 - (Enem) Kırmızı lahanadan elde edilen meyve suyu, farklı çözeltilerin asit (pH 0 ile 7 arasında) veya bazik (7 ile 14 arasında) karakterinin bir göstergesi olarak kullanılabilir. Biraz lahana suyu ve çözelti karıştırılarak, karışım asidik veya bazik yapısına göre aşağıdaki skalaya göre farklı renkler göstermeye başlar.
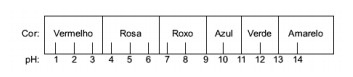
Bu göstergeyle bazı çözümler test edildi ve aşağıdaki sonuçlar elde edildi:
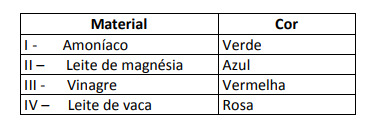
Bu sonuçlara göre sırasıyla I, II, III ve IV çözümleri aşağıdaki karaktere sahiptir:
A) asidik / bazik / bazik / asidik.
B) asit / bazik / asit / bazik.
C) bazik / asidik / bazik / asidik.
D) asit / asit / bazik / bazik.
E) Bazik / Bazik / Asit / Asit.
çözüm
Alternatif E. Maddenin asidik, bazik ve hatta nötr bir karaktere sahip olup olmadığını belirlemek için, testte elde edilen renklerin, verilen ölçeğin verilerine göre bir analizi yapılır. pH = 7 olan çözeltilerin nötr, pH > 7 olan çözeltilerin bazik ve pH < 7 olan çözeltilerin asidik olduğunu bilerek, şu sonuca varırız: amonyak ve magnezya sütünün temel maddeler olduğu ve sirke ve inek sütünün temel maddeler olduğu sonucuna varılmıştır. asitler.
Soru 2 - (PUC-Camp) Asit adı verilen maddelerle ilgili olarak bir öğrenci aşağıdaki özellikleri not etmiştir:
ben - aşındırıcı güce sahibim;
II - bazları nötralize etme yeteneğine sahiptir;
III - iki kimyasal elementten oluşur;
IV - elektrik akımı ileten sulu çözeltiler oluşturur.
SADECE hata yaptı
A) I ve II
B) I ve III
C) I ve IV
D) II ve III
E) III ve IV
çözüm
Alternatif B. Tüm asitler aşındırıcı değildir, yalnızca en güçlüleri aşındırıcıdır ve asitler iki veya daha fazla atomdan oluşabilir.
tarafından Laysa Bernardes
Kimya hocası
