Kimya öğrenen herkes için en büyük zorluklardan biri elektronik dağıtım olarak adlandırılır. Bu bağlamda sunacağımız şey, bilim adamı Linus Pauling tarafından önerilen elektron konfigürasyonu ile ilgili çalışmalarınızı büyük ölçüde kolaylaştırabilir.
Her katmana veya enerji seviyesine uyan maksimum elektron sayısı tabloda verilmiştir:
Enerji Seviyesi Katmanı Maksimum Elektron Sayısı
1. K2
2. L8
3. M 18
4. N32
5° O 32
6. S 18
7. S 8
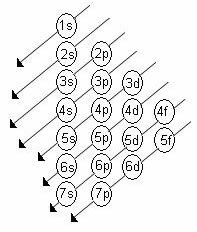
Alt seviyelerin artan enerji sırası, köşegenlerin sıralamasındaki sıradır. Linus Pauling diyagramı aşağıda gösterilmiştir:
Temel kurallar:
1. Nötr durumda elementin atom numarası (Z), dağıtılacak elektron sayısını gösterir. Bu sayı, eleman sembolünün sol alt kısmında temsil edilir.
2. Pauling diyagramını kullanarak, artan enerji sırasını (okların yönüne göre yönlendirilmiş) hesaba katarak elektronları yukarıdan aşağıya dağıtmaya başlayın.
3. Alt seviyeleri maksimum elektron seviyesi ile doldurun. Belirli bir alt seviye yalnızca 6 elektron tutuyorsa, bu miktarı aşmayın.
4. Elektronların sayısını her alt seviyede toplayarak kontrol edin.
Uygulamaya koyalım mı?
Demir atomunun elektronlarını dağıtın (Z=26).
Atom numarası 26 ise, normal demir atomunda 26 elektron olduğu anlamına gelir. Pauling diyagramını uygulayarak şunları elde ederiz:
Şimdi durma... Reklamdan sonra devamı var ;)

Líria Alves tarafından
Kimya mezunu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
FOGAÇA, Jennifer Rocha Vargas. "Elektronik Dağıtım Kuralları"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm. 27 Haziran 2021'de erişildi.