hidratlı tuz bu bir tuz burada bileşiğin iyonları, su moleküllerini kristal kafeslerine dahil eder, bu da bu molekülleri tuz kristalinin bir parçası haline getirir.
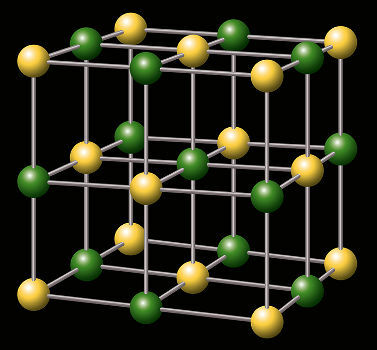
Bir tuzun kristal kafesinin temsili
kimyasal formülü bir hidratlı tuz herhangi bir katyonun varlığına sahip olduğumuz bir model izler (X+), herhangi bir anyon (Y-) ve belirli bir miktar (n) aşağıdaki modelde görülebileceği gibi mol su olarak:
XY.nH2Ö
oluşturmak için bir isimlendirme hidratlı tuz, aşağıdaki kuralları yerine getirmeliyiz:
Anyon adı + de + katyon adı + önek + hidratlı
Not: İsimlendirme kuralında belirtilen önek, tuz formülünde bulunan suyun mol cinsinden miktarına atıfta bulunur, dolayısıyla 1 mol (mono), 2 mol (d), 3 mol (tri), vb.
1. Örnek: FeCl2.2.H2Ö
Bu hidratlı tuz aşağıdaki bileşenlere sahiptir:
Demir katyon II (Fe+2);
Klorür anyonu (Cl-);
2 mol H2O (di öneki).
Yani adı demir II klorür dihidrat olacaktır.
2. Örnek: MgSO44.7.H2Ö
Bu hidratlı tuz aşağıdaki bileşenlere sahiptir:
Magnezyum Katyonu (Mg+2);
Sülfat anyonu (SO4-2);
7 mol H2O (hepta öneki).
Yani adı magnezyum sülfat heptahidrat olacaktır.
3. Örnek: ZnBr2.8.H2Ö
Bu hidratlı tuz aşağıdaki bileşenlere sahiptir:
Çinko katyon (Zn+2);
Bromür anyonu (Br-1);
8 mol H2O (sekiz öneki).
Yani adı çinko bromür oktahidrat olacaktır.
kimyasal modifikasyon
Hidratlı bir tuz bir ısıtma işlemine tabi tutulduğunda, kristal yapıya dahil olan su molekülleri, yalnızca basit bir tuz bırakarak buhar şeklinde salınır.
Benden. Diogo Lopes
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-sal-hidratado.htm