bu tuz hidrolizi kuvvetli asitler ve bazlar arasında bir tuzdaki katyon sudaki anyon ile etkileşime girmediğinde ve tuzdaki anyon sudaki katyonla etkileşime girmediğinde oluşur. Bir tuz ve suyun katyonları ve anyonları arasındaki hidroliz, yalnızca oluşan ürün zayıf bir asit, zayıf bir baz veya her ikisi olduğunda meydana gelir. Güçlü asitler ve güçlü bazlar arasındaki tuz hidrolizini adım adım anlayın:
a) Adım 1: su iyonlaşması
Su, acı çekme yeteneğine sahip bir maddedir. otoiyonizasyonyani hidronyum katyonu üretir (H+) ve hidroksit anyonu (OH-) yapısından kaynaklanmaktadır.
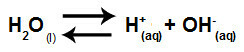
Suyun kendi kendine iyonlaşmasını temsil eden denklem
b) Adım 2: Ayrışma tuzun
Suya bir tuz eklendiğinde, ayrışma sürecinden geçer. Tuz iyonik bir bileşik olduğundan, suda katyonları ve anyonları aşağıda gösterilen denklemde olduğu gibi ortama salınır:
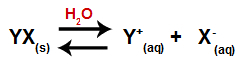
Herhangi bir tuzun ayrışmasını temsil eden denklem
c) Adım 3: Güçlü asit ve bazların tuz hidrolizi
Güçlü asit için: tuzun anyonu H ile birleştiğinde+ Hidrojen sayısı ile oksijen sayısının çıkarılmasının 2'ye eşit veya daha büyük olduğu HCl, HBr, HI veya başka bir asit oluşturmak için suyun
güçlü asit. Bu nedenle bahsedilen iyonlar arasında kombinasyon oluşmaz.Güçlü bir temel için: IA (alkali metaller) veya IIA (magnezyum dışındaki alkali toprak metaller) ailelerine ait tuzun katyonu OH ile birleştirildiğinde- bir su oluşturacak güçlü temel. Bu nedenle bahsedilen iyonlar arasında kombinasyon oluşmaz.
Tuz iyonları su iyonlarıyla etkileşime girmediğinde, aşağıdaki denkleme sahibiz:
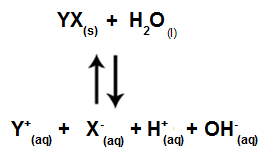
Çözeltide bulunan tüm iyonları gösteren denklem
Özetle, tuz iyonları su iyonları ile etkileşime girmediğinden, tuz iyonları nihai çözeltide herhangi bir değişiklik yaratmaz. Böylece kuvvetli asitler ve kuvvetli bazlar arasındaki bir tuz hidrolizinin denklemini sadece su iyonlaşma denklemi ile yazabiliriz.
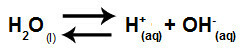
Güçlü asit ve bazların hidrolizini temsil eden denklem
d) Kuvvetli asitler ve bazlar arasındaki tuz hidrolizi örneği
Potasyum klorat tuzunu suya eklediğimizde (KClO3), tuz ayrışır ve potasyum katyonunu serbest bırakır (K+) ve klorat anyonu (ClO3-) ortada.
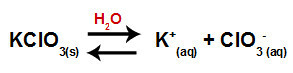
Potasyum klorat için ayrışma denklemi
Suyun kendi kendine iyonlaşmaya uğradığını ve ortama hidronyum katyonu (H) sağladığını hatırlamak önemlidir.+) ve hidroksit anyonu (OH-). Şimdi tuz ve su iyonları arasındaki etkileşimi değerlendirmeliyiz.
H olduğunda+ ClO ile etkileşime girer3-perklorik asit (HclO) oluşturur.3). Perklorik asitte iyonlaşabilen hidrojenlerin sayısından oksijen sayısının çıkarılması 2 olduğundan kuvvetlidir. Bu nedenle iyonlar arasında etkileşim oluşmaz.
K katyonu olduğunda+ OH anyonu ile etkileşir-Potasyum bir alkali metal olduğu için güçlü bir baz oluşumuna sahibiz. Bu nedenle iyonlar arasında etkileşim oluşmaz.
Potasyum kloratın suda çözünmesinden kaynaklanan güçlü asitler ve bazlar arasındaki tuz hidrolizini temsil eden denklem şöyledir:
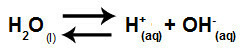
Potasyum klorat hidrolizinin kimyasal denklemi
Benden Diogo Lopes Dias
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm
