Amerikalı kimyager Gilbert N. Lewis (1875-1946) oktet kuralını önerdi ve şöyle dedi:
"Farklı elementlerin atomları, elektronların elektronik konfigürasyonunu elde etmek için elektronları bağışlayarak, alarak veya paylaşarak kimyasal bağlar kurar. soy gaz, yani, son kabukta 8 elektronlu (veya sadece bir elektron kabuğuna sahip olan atomlar durumunda 2 elektronlu) hidrojen)."
1916'da Lewis sabit kalabilmek için sekizliye veya düet'e ulaşarak diziyi oluşturan unsurların moleküler maddeler elektron çiftlerinin paylaşımını gerçekleştirir. Bu maddeler sadece atomlardan oluşur. hidrojen, metal olmayanlar ve yarı metaller, hepsi ile elektron alma eğilimi. Bu nedenle, herhangi birinin herhangi bir elektron bağışlamasının bir yolu yoktur (iyonik bağlardaki metallerde olduğu gibi), ancak herkesin alması gerekir, bu nedenle elektronlarını kovalent bir bağ veya moleküler.
Böylece, Gilbert Lewis, kovalent veya moleküler bağı temsil etmenin bir yolunu önerdi. Lewis formülü. O da denir elektronik formül ya da henüz,
Lewis'in elektronik formülüçünkü ana özelliği, her atomun değerlik kabuğundaki elektronları ve elektronik çiftlerin oluşumunu gösterir.Her elektron bir nokta ile temsil edilir., karşılık gelen kimyasal elementin sembolünü çevreleyen. Sadece değerlik kabuğu elektronları elementin etrafındadır.
Aşağıdaki tabloda gösterildiği gibi, değerlik kabuğundaki elektron miktarını bilmek için Periyodik Tablo ailesini bilmeniz yeterlidir:

Lewis formülünde, paylaşılan her elektron çifti bir kimyasal (kovalent) bağı temsil eder, elektronların, birbirine bağlanan her bir atom çifti için ortak olan elektrosfer bölgesinde buluştuğu yer. Bu nedenle temsilde yan yana yerleştirilmiştir.
Örneğin, moleküler formülü H olan hidrojen gazı için Lewis formülünün ne olduğunu bulalım:2.
Her hidrojen atomunun değerlik kabuğunda sadece bir elektronu vardır, çünkü bu element Periyodik Tablonun 1. ailesine aittir. Her birinin, K elektron kabuğunda iki elektronla kararlı olması için bir elektron daha alması gerekir. Böylece elektronlarını paylaşırlar ve ikisi de iki tane alır. Bak:
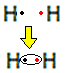
Bu, hidrojen gazı molekülü için Lewis formülüdür.
Oksijenin elektron kabuğunda altı elektron vardır, bu nedenle her birinin kararlı olması için sekiz elektronlu iki elektron daha alması gerekir. Bu nedenle, oksijen gazı molekülü için Lewis formülü:

İki paylaşılan çift olduğu için iki bağlantı olduğunu görün.
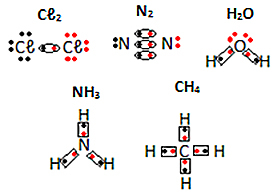
Aşağıdaki moleküler maddelerin elektronik formüllerinin diğer örneklerine bakın:
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm
