difüzyon ve efüzyon İskoç kimyager Thomas Graham'ın 19. yüzyılda yaptığı çalışmalara dayanarak önerdiği iki yasadır. gaz karışımları ve davranışı gazlar bir konteynerin duvarlarından geçerken.
Thomas Graham'ın gazların difüzyon ve efüzyonla ilgili davranışları üzerine yaptığı gözlemler arasında aşağıdakileri vurgulayabiliriz:
Bir gazın her zaman katı hal maddesinde bulunan küçük deliklerden geçme eğilimi vardır;
daha büyük molekül kütlesi gaz, katı maddenin deliklerinden geçme zorluğu arttıkça;
Gaz yoğunluğu ne kadar düşük olursa, hareket hızı o kadar yüksek olur;
Bir gazın maruz kaldığı sıcaklık ne kadar yüksek olursa, ortama yayılma veya bir delikten geçme hızı o kadar yüksek olur;
- Bir gaz belirli bir yerde asla statik kalmaz.
difüzyon
difüzyon bir gazın bir alan boyunca veya bir kap içinde yayılma (yani yayılma) yeteneğinden oluşan fiziksel bir olgudur. Bu nedenle, bir boşluk içinde bir gazın asla tek bir mekanla sınırlı olmadığını söyleyebiliriz.

Bir yayının oluşumunun temsili
Ek olarak, tanımlayabiliriz
yayılma yine de, bir gazın aynı kaba konduğunda homojen bir gaz karışımı oluşturan diğeriyle karışması gereken kapasitedir.Bir örnek, gazların araç egzozlarından çıkmasıdır. Zehirli olmalarına rağmen, atmosferik havaya yayıldıkları ve dolayısıyla konsantrasyonlarını azalttıkları için insanlarda kısa süreli hasara neden olmazlar.
Efüzyon
Efüzyon belirli bir kabın duvarlarında bulunan deliklerden bir gazın geçişinden, yani bir gazın bir ortamdan diğerine çıkışından oluşan fiziksel bir olgudur.

Dışkılama olayının temsili
Bir örnek, bir parti için balonların şişirilmesi ve ertesi gün balonların içindeki deliklerden kaçan hava nedeniyle hepsinin sönmesidir.
Difüzyon ve efüzyon ile ilgili hesaplamalar
Graham tarafından önerilen denklemlere göre, bir gazın gerçekleştirdiği hızı hesaplayabiliriz. difüzyon veya efüzyon. Graham'a göre, bir kapta karıştırılan iki gazın difüzyon ve efüzyon hızları her zaman göreli yoğunluklarının veya molar kütlelerinin karesiyle ters orantılıdır.
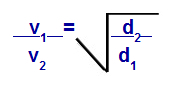
Yoğunluk ile ilgili Graham Yasası
v1 = karışımdaki gaz 1'in hızı (efüzyon veya difüzyon);
v2 = karışımdaki gazın 2 hızı (efüzyon veya difüzyon);
d1 = karışımın 1 gazının yoğunluğu;
d2 = karışımın 2 gazının yoğunluğu;
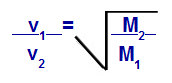
Graham'ın Molar Kütle ile İlgili Yasası
v1 = karışımdaki gaz 1'in hızı (efüzyon veya difüzyon);
v2 = karışımdaki gazın 2 hızı (efüzyon veya difüzyon);
M1 = karışımın gaz 1 molar kütlesi;
M2 = karışımdaki gaz 2'nin molar kütlesi.
Benden Diogo Lopes Dias
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm

