Ö atom yarıçapı (r) genellikle olarak tanımlanır komşu atomların iki çekirdeği arasındaki mesafenin yarısı, aşağıdaki şeklin temsil ettiği gibi:

atom yarıçapı
Atom yarıçapı, Periyodik Tablodaki ailesine ve periyoduna göre bir atomdan diğerine farklılık gösterir. Bir gruba ait olan elementler ile ilgili olarak aynı ailede, atom numarası arttıkça atom yarıçapı artar.yani yukarıdan aşağıya. Zira bu anlamda, bir atomdan diğerine bir enerji seviyesinin veya elektronik katmanın arttığı, dolayısıyla yarıçapının orantılı olarak arttığı anlamına gelir.
eleman ile ilgili olarak aynı dönemde, yani, yatay olarak, yarıçap sağdan sola doğru artar veya atom numarası azaldıkça. Bunun nedeni, hepsinin aynı sayıda katmana sahip olmalarıdır, farkı yaratan, katmanların miktarıdır. Bu katmanlardaki elektronlar ve elektron sayısı arttıkça çekirdeğe olan çekim artar, böylece atom.

Periyodik Tabloda aile ve periyoda göre atom yarıçapı büyüme yönü
Ancak yapılan bağlantıya göre atom yarıçapı değişebilir. Bunun nasıl olduğunu görelim:
*İyonik bağ: atom oluşturursa katyon, atom yarıçapı azalır, bir veya daha fazla elektron kaybettiği için çekirdek elektronları daha yoğun bir şekilde çekecektir. Şimdi eğer bir anyon oluştur, yani elektron kazan, atomun yarıçapı artacak, çünkü elektrosferin toplam yükü, çekirdeğin toplam yükünden daha büyük olacak ve çekiciliğini azaltacaktır. Ne kadar çok elektron kazanır veya kaybederseniz, ışının boyutundaki değişim o kadar büyük olur.
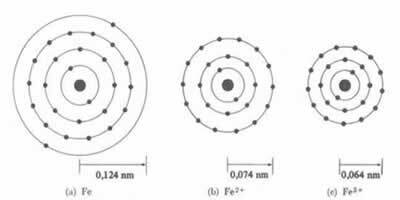
Katyonun çapı veya yarıçapı her zaman atomun çapından veya yarıçapından daha küçüktür.
Ayrıca bir dizide izoelektronik iyonlarAynı miktarda elektrona ve enerji seviyesine sahip olan atomlarda, atom numarası en küçük olan iyon daha büyük bir yarıçapa sahip olacaktır. Örneğin, iyonlar 13Al3+, 12mg2+, 11at1+, 9F-1, 8Ö2- ve 7N-3, hepsinin 10 elektronu ve 2 elektronik seviyesi vardır. Ama en büyük yarıçapa sahip olan, 7N-3, çünkü en küçük atom numarasına sahiptir (Z= 7).
*Kovalent bağ: İki atom kovalent bağ yaptığında, iki atom eşitse, hidrojen gazı durumunda olduğu gibi (H2), bağın (d) uzunluğunun yarısı olan, yani iki çekirdeği ayıran mesafenin yarısı olan bir kovalent yarıçaptan (r) bahsedilebilir.. Olmasına rağmen, bağ farklı atomlar tarafından yapılırsa, hidrojen klorür (HCl) durumunda olduğu gibi, uzunluk veya mesafe (d), kovalansa dahil olan atomların kovalent yarıçaplarının (r1 + r2) toplamı olacaktır.
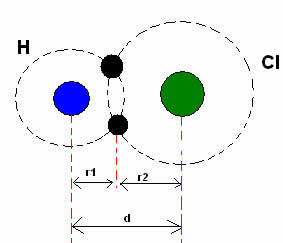
Kovalent bağdaki atom yarıçaplarının toplamı.
Elbette, bir atomun kovalent yarıçapı, diğer farklı atomlarla bağ kurdukça değişebileceğinden, bu konunun çok daha karmaşık olduğunu unutmamalıyız.
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm
