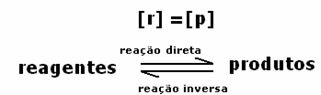
Bir reaksiyonun dinamik dengesi veya kimyasal dengesi, ileri ve geri reaksiyonlar aynı anda meydana geldiğinde meydana gelir. Bu tersine çevrilebilir sistemler, her iki yönde de oklarla temsil edilir:  veya
veya  . Yukarıdaki resimde, iyot gazı ve hidrojen gazı arasında tersinir bir reaksiyon örneği verilmiştir.
. Yukarıdaki resimde, iyot gazı ve hidrojen gazı arasında tersinir bir reaksiyon örneği verilmiştir.
Reaksiyonun başlangıcında, reaktanların miktarı maksimumdur ve ürünlerinki sıfırdır. Bununla birlikte, reaktanlar birbirleriyle reaksiyona girerek konsantrasyonlarını azaltır ve oluşan ürünlerin konsantrasyonlarını arttırır. Doğrudan reaksiyonun gelişme hızı da azalmaktadır.
Ürünlerin konsantrasyonu arttıkça ters reaksiyon başlar ve reaktanlar tekrar oluşur; ters reaksiyonun gelişme hızı da artar.
Kimyasal dengeye ulaşıldığında, sabit sıcaklıkta ileri ve geri reaksiyonların gelişme hızları eşittir.
Herşeydoğrudan = Hepsi ters
Oranlar aynıdır, ancak konsantrasyonlar değildir. Reaktiflerin ve ürünlerin konsantrasyonlarının aynı olması olası değildir. Bu sadece nadir durumlarda gerçekleşir. Çoğu durumda, reaktiflerin konsantrasyonu, ürünlerinkinden daha yüksek olacaktır veya bunun tersi de geçerlidir.
Bu nedenle, kalkınma oranlarını grafiksel olarak temsil etmenin üç olası yolu var. reaktanların ve ürünlerin konsantrasyonları ile ilgili doğrudan ve ters reaksiyonlar zaman. Her bir duruma bakalım:
1. durum: Eşit konsantrasyonlar:
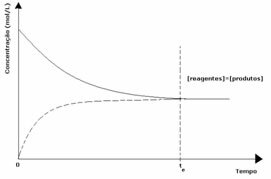
Grafikte görüldüğü gibi, t anındave ileri ve geri reaksiyonlar aynıdır, bu durumda reaktanların ve ürünlerin konsantrasyonları aynıdır. Böylece, denge her iki tarafa da kaymaz, aşağıda ifade edildiği gibi her iki reaksiyonun yoğunluğu aynıdır:
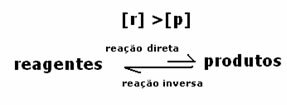
2. durum: Ürün konsantrasyonundan daha büyük reaktif konsantrasyonu:
Bu durumda, dengeye ulaşıldığında, reaktanların konsantrasyonunun ürünlerinkinden daha büyük olduğu gözlenir. Böylece, daha fazla reaktan varsa, ters reaksiyonun daha yoğun bir şekilde meydana geldiği sonucuna varılır. Reaksiyon sola kaydırılır:
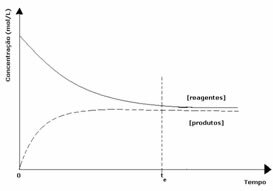
3. durum: Reaktiflerinkinden daha büyük ürünlerin konsantrasyonu:
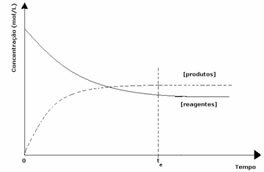
Dengede ürünlerin konsantrasyonu daha büyük olduğundan, bu, reaksiyonun sağa kaydırıldı, çünkü doğrudan reaksiyon (ürün oluşumu ile) daha büyük yoğunluk.
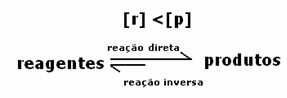
Reaksiyonun sağa mı yoksa sola mı yöneldiğini gösterecek olan, yalnızca sıcaklığa bağlı olan denge sabiti K olacaktır.
Jennifer Foğaça tarafından
Kimya mezunu
Brezilya Okul Takımı
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm

