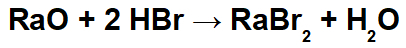Bir kimyasal denklem, bir reaksiyona katılan reaktanların ve ürünlerin gösterildiği kimyasal işlemlerin tanımı olarak anlaşılır:
C + O2→ CO2
Ürün Reaktifleri
Kimyasal bir bağın oluşabilmesi için tepkenlerdeki mevcut bağların kopması ve ürünlerde yeni bağların oluşması gerekir. Bu süreç, reaksiyonların enerji değişiminin incelenmesini içerir.
Enerji temini, reaktanların bağlanmasının kırılmasına (endotermik süreç) izin verirken, üründe bağların oluşumu, enerji açığa çıktığı için ekzotermik bir süreçtir.
Bağlanma enerjisi, ürünün oluşumunda açığa çıkan ve bu bağın kırılmasında emilen enerjiye sayısal olarak eşittir, dolayısıyla bağlanma enerjisi bağların kırılması için tanımlanır.
Özetle: Bağ enerjisi, gaz halinde, 25 °C ve 1 atm'de 1 mol bağın kırılmasında emilen enerjidir.
Şimdi reaksiyonların bağlanma enerjisinin nasıl elde edileceğine dair bir örneğe bakın:
HCl (g) → H (g) + Cl (g) ∆H = + 103.0 Kcal/mol
Yukarıdaki denklem, bağları 1 mol HCl molekülüne (g) kırmak ve 1 mol HCl atomu oluşturmak için göstermektedir. H(g) ve 1 mol Cl atomu (g), 103.0 Kcal gereklidir, yani HCl'nin bağlanma enerjisi (g) = + 103.0 Kcal/mol.
Bağ kararlılığı: Bağ enerjisi ne kadar yüksekse bağ o kadar kararlıdır. Misal:
Aşağıdaki bağlanma enerjileri verilirse:
H2O (1) → H2 (g) + O (g) ∆H = + 110,6 Kcal/mol
HBr (g) → H (g) + Br (g) ∆H = + 88.0 Kcal/mol
HBr'de veya H'de bulunan en kararlı bağ ne olurdu?2Ö?
Su bağlama enerjisi (H2O) HBr'den daha yüksek bir değere sahiptir, dolayısıyla daha fazla kararlılığa sahiptir.
Líria Alves tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/energia-ligacao-equacoes-quimicas.htm