bu oktet teorisi bir kimyasal elementin atomunun kararlı olması için bir soy gazın elektronik konfigürasyonunu alması gerektiğini belirtir, yani değerlik kabuğunda sekiz elektrona veya atom yalnızca ilk elektron kabuğuna sahipse iki elektrona sahip olmalıdır. (K).
Berilyum 4'e eşit bir atom numarasına sahiptir. Bu nedenle, atomunuz 4 elektrona sahiptir ve temel durumdaki elektronik dağılımı şu şekilde verilir:

Berilyum elektronik konfigürasyonu
Bu, berilyumun son kabuğunda 2A ailesinden (alkali toprak metalleri) olmak üzere 2 elektrona sahip olduğu anlamına gelir. Böylece, bu iki elektronu verme eğilimine sahip olacak, 2+ yükünü alacak, yani iyonik bağ oluşturma eğilimine sahip olacaktır.
Bununla birlikte, berilyum atomlarının, aşağıda oluşan bileşikte gösterildiği gibi elektron paylaşımlı kovalent bağlar yaptığı gözlemlenmiştir, berilyum hidrit (BeH)2):
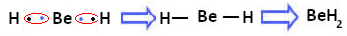
Hidrojen ile berilyumun kovalent bağlarının oluşumu
Bu durumda berilyumun değerlik kabuğunda sekizden az elektronla kararlı olduğuna dikkat edin, çünkü elektronlarını hidrojen atomları gibi paylaşır, şimdi son atomunda dört elektronu vardır. katman. Bu nedenle, bir
oktet kuralının istisnası.Ancak kovalent bağ genellikle elementin eksik yörüngelere sahip olması nedeniyle oluşur. Örneğin, aşağıda gösterildiği gibi, hidrojen eksik bir yörüngeye sahiptir, bu nedenle yalnızca bir kovalent bağ yapar. Oksijenin iki eksik orbitali vardır ve iki kovalent bağ yapar. Azot, sırayla, üç eksik orbitale sahiptir ve sonuç olarak, üç kovalent bağ yapar:
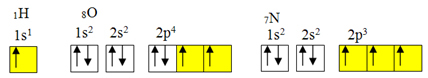
Hidrojen, oksijen ve azotun elektronik dağılımları
Bununla birlikte, daha önce gösterildiği gibi, berilyumun eksik yörüngeleri yoktur.
Peki neden kovalent bağ yapar?
Açıklama şurada hibridizasyon teorisi, bunu söyleyen bir yörüngeden bir elektron enerji aldığında, en dıştaki boş yörüngeye "atlar", uyarılmış durumda kalmak ve böylece eksik atomik orbitallerin kaynaşması veya karışması meydana gelir, üreten hibrit yörüngeler birbirine eşdeğerdir ve orijinal saf orbitallerden farklıdır.
Örneğin, berilyum durumunda, 2s alt seviyesinden bir elektron enerji alır ve boş olan bir alt seviye 2p yörüngesine geçer:

Berilyum hibrit orbitallerin oluşumu için uyarılmış durum
Bu şekilde, berilyum iki eksik orbitale sahiptir ve iki kovalent bağ yapabilir.
Bir yörüngenin "s" alt seviyesinde ve diğerinin "p"de olduğuna dikkat edin, bu nedenle berilyumun gerçekleştireceği bağlamalar farklı olmalıdır. Ancak, olan bu değil, çünkü fenomen ile hibridizasyonoluşan bu eksik orbitaller karışacak ve adı verilen iki orbital üretecektir. melezler veya melezleştirilmiş, birbirine eşittir. Ayrıca bu iki hibrit orbital bir "s" ve bir "p" orbitalinden geldiği için bu hibritleşmenin şu tipte olduğunu söylüyoruz. sp:

Berilyum sp hibridizasyon oluşumu
Hibrit orbitaller aynı olduğundan berilyumun hidrojen atomlarıyla yaptığı kovalent bağlar da aynı olacaktır:

Hibrit berilyum orbitallerinin hidrojenlerin s orbitalleriyle iç içe geçmesi
Daha sonra s-sp (σ) tipinde iki sigma bağı oluşturduğuna dikkat edin.s-sp).
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/hibridizacao-berilio.htm
