Genellikle, reaksiyonların sulu elektroliz ve magmatik elektroliz reaksiyona katılmayan grafit ve platin elektrotlarla gerçekleştirilirler; sadece elektrik akımını iletirler. Ancak, kullanılması gereken bazı özel durumlar vardır. aktif elektrotlaryani, indirgenme ve oksidasyona uğrayanlar.
Redoks işlemine katılan bu elektrotların ana kullanım durumları şunlardır: elektrolitik metal arıtmaçinko, kobalt, nikel ve esas olarak bakır gibi; ve ayrıca galvanik. Her bir vakanın nasıl gerçekleştiğini görelim:
• Bakır Elektrolitik Arıtma: Bu elektrolitik bakır arıtma, yaklaşık %99.9 saflık üretebilir ve esas olarak en az miktarda safsızlık varsa, çok elektrik akımı iletme kabiliyetine sahip olabilen bakır teller azalmış.
Aşağıda monte edilmiş bir elektrolitik kazanın şemasını görerek, bu işlemin nasıl gerçekleştiğini gözlemleyin:

Bakır Sülfat sulu çözeltisine (CuSo4(sulu)) - elektriği ileten - böylece saf olmayan bir metalik bakır olan anot elektron kaybeder, yani oksidasyona uğrayarak katyonlarını (Cu) serbest bırakır.
2+), negatif plaka üzerinde biriktirilir. Bu, atıl bir platin levha veya daha iyisi saf bir bakır levha olabilir. İçinde bakır biriktikçe indirgenen katodu oluşturur. Böylece elektrotlarda meydana gelen yarı reaksiyonlar: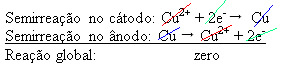
Sıfır sonuç vermesi, kimyasal reaksiyon olmadığını, sadece bakırın taşınması olduğunu gösterir. Altın, gümüş, silis (kum) ve diğer mineraller gibi bakırda bulunan ve hatta satılabilen diğer necis maddeler var.
• galvanik: Korozyondan korunacak bir malzemeye metalik bir kaplama uygulanır.
Kaplama için seçilen metal - krom (krom), nikel (nikel), gümüş (gümüş), altın (yaldız) veya çinko (galvanizasyon) - oksidasyona uğrayan, elektron kaybeden anot, pozitif elektrot olacaktır. İndirgeme potansiyeli daha büyük olduğu için korunan malzemenin yerine oksidasyona uğrar.
Negatif elektrot, yani bu elektronları alan ve indirgenen katot, kaplanan malzemenin kendisidir. Bu şekilde, yüzeyi bir şekilde ihlal edilse bile korunmaya devam eder.
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm
