Periyodik Tablonun 17 veya VII A ailesinin elemanlarına, aşağıda listelenen beş elementle temsil edilen Halojenler denir: Flor (F), Klor (Cl), Brom (Br), İyot (I) ve Astatin (At). Genellikle genel olarak X harfi ile temsil edilirler.

Günlük uygulamalarından dolayı en önemlileri klor, brom ve iyottur.
Bu isim "halojen", "tuz oluşturan" anlamına gelir.
Hepsinin değerlik kabuğunda (çekirdeğe en dıştaki elektronik kabuk ve daha enerjik) 7 elektron vardır. Genel olarak: ns2 np5. Sonuç olarak, bir elektron alma ve negatif tek değerli iyonlar oluşturma eğilimindedirler (X-1), esas olarak bir elektron verme eğiliminde olan alkali metallerle (aile 1 metalleri) reaksiyona girer. Böylece MX tipi formüllü bileşikler meydana getirirler.

Bu elektronu kazanarak, değerlik kabukları (sekiz elektronlu) tamamlandığından ve özellikleri tamamen değiştiğinden halojenler kararlıdır. Örneğin, klor gazı (Cl2) yeşilimsi sarı, yoğun, yüksek derecede toksik ve reaktif bir gazdır, suda az çözünür ve hidrojen ile patlayıcı şekilde reaksiyona girer. Ancak, ne zaman
klor (Cl), sodyumdan (Na) bir elektron alır, iyon haline gelirler ve günlük olarak aldığımız ve hayatımızı sürdürmek için gerekli olan sodyum klorürü (NaCl) veya sofra tuzunu oluştururlar. Klor özellikle klorür iyonu olur (Cl-Mide suyumuzun ana bileşeni olan hidroklorik asit (HCl) oluşumu için vücudumuzda gereklidir.Aslında klor, halojenlerin en bol olanıdır ve organik bileşiklerin üretiminde kullanılır. inorganik, kağıt imalatında (kağıt hamuru ağartmayı amaçlayan) ve su ve kanalizasyon. "Sıvı klor" olarak adlandırılan ve ağartıcının bileşiminde bulunan sulu bir sodyum hipoklorit (NaClO) çözeltisinin kullanılması da yaygındır.
İlginç bir gerçek şu ki, bazı insanlar yüzme havuzlarında “katı klor” kullanıldığını söylese de, aslında sadece klor elementi değil, kalsiyum hipoklorittir (Ca (ClO)).2).
Ayrıca, benzer bir durum, flor – aslında kendi başına flor değil, florürler (flor elementini içeren iyonik bileşikler) – içme suyu tedavisinde ve ağız bakım ürünlerinde.
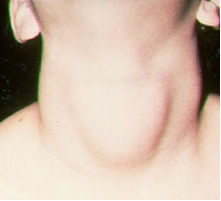
Saygıyla iyot, önemli bir uygulama, sofra tuzuna yasaların gerektirdiği şekilde (iyodürler veya sodyum ve potasyum iyodatlar şeklinde) eklenmesidir. Bunun nedeni, vücuttaki iyot eksikliğinin, halk arasında papo olarak bilinen guatr adı verilen bir hastalığa neden olabilmesidir.
Ö brom oda sıcaklığında, yoğun ve kararsız kırmızı bir sıvıdır ve uçucu olduğu için buharlaşarak kırmızımsı bir buhar oluşturabilir. Doğada tek başına bulunmaz ve endüstride bu şekilde kullanılmaz. Bileşiklerinin ana uygulamaları şunlardır: diğerlerinin yanı sıra fotografik gelişmelerde yakıtlarla karıştırılmış organik reaksiyonlar için katalizörler olarak.
zaten astatin radyoaktif bir elementtir. Kökeni genellikle uranyum ve toryum izotoplarının radyoaktif bozunmasının bir sonucudur. En az 20 izotop oluşturur, At-210 en kararlı olanıdır ve yarılanma ömrü 8.3 saattir. Çok nadir bir elementtir.
Jennifer Foğaça tarafından
Kimya mezunu
