Karbonatlar, bir metal veya yarı metalin karbonat anyonu CO ile iyonik bağlanmasıyla oluşan inorganik bileşiklerdir.32-.
Karbon dört değerlidir, yani değerlik kabuğunda dört elektrona sahiptir ve dört kovalent bağın kararlı olmasını sağlayabilir, oksijen iki değerlidir, değerlik kabuğunda altı elektrona sahiptir ve sekiz ile kararlı olmak için iki bağ yapabilir. elektronlar. Bu nedenle, bir karbon için, tümü kararlı olan iki oksijen atomuna bağlanma yönünde güçlü bir eğilim vardır (O ═ C ═ O → CO2).
Ancak diğer oksijen karbon ile birleşebilir, çünkü iyonik yarıçapların oranı 3'e eşit bir koordinasyon sayısına yol açarak bir yapı oluşturur. karbonun merkezde olduğu üçgen, oksijen atomlarından biri ile çift, diğer ikisi ile iki tekli bağ yapar. oksijenler. Sonuç, iki fazla elektrondur, çünkü bu iki oksijen kararlı değildir ve her birinin bir elektron alması gerekir:
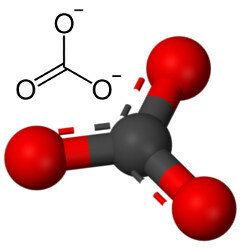
Karbonat anyonu kovalent bağlardan oluşur, ancak inorganik tuzlar ve mineraller olan bileşikleri karbonatlar olarak bilinenler iyoniktir, çünkü bu radikal bir metal veya yarı metalden iki elektron alarak bir iyonik bağ.
Bu bileşikler, amonyum karbonat ((NH4)2CO3) ve alkali metallerle oluşturulan karbonatlar (aile 1: Li, Na, K, Rb, Cs ve Fr). Aşağıdaki resimde gösterildiği gibi hemen hemen hepsi beyaz katılardır:

Karbonatların en yaygın ve en önemli iki günlük örneği sodyum karbonattır (Na2CO3) ve kalsiyum karbonat (CaCO3). İlk durumda, sodyum, değerlik kabuğunda bir elektrona sahip olan ve kararlı hale gelmek için bu elektronu kaybetme eğiliminde olan aile 1'e aittir. Karbonat anyonunun iki elektron alması gerektiğinden, iki sodyum atomuna bağlanır:

Soda külü, sabun, boya, ilaç, kağıt üretiminde ve yüzme havuzu suyunun arıtılmasında kullanılan soda veya soda olarak daha iyi bilinir. Ancak ana uygulaması, cam üretiminde kalsiyum karbonat ve kumdur.
Kalsiyum, iki elektron kaybetme eğiliminde olan 2. ailedir. Böylece, bir kalsiyum atomu bir karbonat radikaline bağlanır:

Kalsiyum karbonat kireçtaşı ve mermerde bulunur. at sarkıt ve dikitler mağaralarda bulunan bu karbonattan; kabukları, mercan resifleri ve yumurta kabukları da. Duvarları, ağaç gövdelerini ve diğer yerleri badanalarken kalsiyum hidroksit (Ca(OH) kullanıyoruz.2), zamanla atmosferik karbon dioksit ile reaksiyona girerek kalsiyum karbonat oluşturur.

Karbonatlar, minerallerde olduğu gibi dünya yüzeyinde çok yaygındır. Kristal retikulumu uzayda kendisini iki şekilde yeniden düzenleyebilir: ortorombik (yukarıda kalsiyum karbonat formülüyle birlikte gösterilen mineral aragonitte olduğu gibi) ve kalsit (kalsiyum karbonattan oluşan başka bir mineral) durumunda olduğu gibi eşkenar dörtgen veya trigonal.
Karbonatlar asitlerin varlığında reaksiyona girerek CO2 açığa çıkarır.2, bir efervesans yoluyla kolayca görülebilir.
Jennifer Foğaça tarafından
Kimya mezunu

