bu Tepkime Hızı Yasası kimyasal dönüşümün hızını, aşağıdaki gibi ifade edilebilen madde miktarı (mol/L) cinsinden reaktiflerin konsantrasyonları ile ilişkilendirir:

Örneğin, aşağıdaki genel reaksiyonu düşünün:
aA + bB → cC + dD
Diyelim ki A ve B reaktanlarının konsantrasyonunu arttırıyoruz, reaksiyonun hızına ne olacak? Eh, aynı boşlukta reaktan parçacıklarının miktarı artacağından, aralarında daha etkili çarpışmalar olacak ve bu da reaksiyon gelişme hızında bir artışa neden olacaktır. Bu da hızınızı artıracağı anlamına gelir.
Bu nedenle, reaksiyon hızı, reaktanların konsantrasyonu ile doğru orantılıdır. Ancak, sıcaklığa da bağlıdır. Bu nedenle, reaksiyon hızı yasasını temsil eden aşağıdaki matematiksel denkleme sahibiz:

Ne üzerine:
v = reaksiyon hızı;
k = sadece sıcaklık değerine bağlı olan sabit;
α ve β = deneysel olarak belirlenen üsler.
Sadece reaksiyon temel olduğunda, yani tek bir adımda meydana geldiğinde, üsler tam olarak dengeli kimyasal denklemin katsayılarına eşittir: v = k. [BU]. [B]B
. Bununla birlikte, diğer durumlarda, her bir reaktifin konsantrasyonunun yükseltilmesi gereken uygun güç deneysel olarak belirlenmelidir.Tepkime hızı kanunu birçok isimle anılır, işte bunlardan bazıları: Kütle Etkisi Yasası, Hızlılık Denklemi, Kinetik Tepki Yasası ve Guldberg-Waage Yasası.
Bu yasanın nasıl uygulanacağına dair bir örnek düşünün:
Aşağıdaki temel reaksiyonu düşünün:
2 HCl (g) → H2(g) + Cl2(g)
a) Bu reaksiyonun hızı için denklemi yazın;
b) Deneyler yoluyla, bu hidrojen klorür gazı ayrışma reaksiyonunun hızı ve bu reaktifin konsantrasyonu, 25 °C sabit sıcaklıkta aşağıdaki tabloda not edilmiştir:
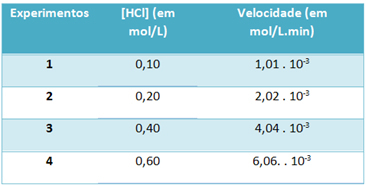
Buna dayanarak, belirtilen sıcaklıkta bu reaksiyonun karakteristik hız sabitini belirleyin.
Çözüm:
) v = k. [HCl]2
b) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 mol. L-1. dk-1
0.01 mol. L-1
k=1.01. 10-1 dk-1
“b” harfini çözmek için, elde edilen değerin aynı olacağı deneylerden herhangi birinin verilerini kullanabilirsiniz.
Peki ya tepki temel değilse? Temel olmayan reaksiyonlarda bunun gibi soruları çözmek nasıl mümkün olacak? Nasıl olduğunu öğrenmek için, temel olmayan reaksiyonlar için hız yasasını okuyun.
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm

