NS çözünürlükolarak tanımlanabilir belirli bir sıcaklıkta belirli bir miktarda çözücü içinde çözülebilen maksimum olası çözünen miktarı.
Çözülebilen bu maksimum miktar aynı zamanda olarak da bilinir. çözünürlük katsayısı veya çözünürlük derecesi. Ancak herhangi bir maddenin çözünürlüğü, diğer şeylerin yanı sıra, çözünenin içinde dağıldığı çözücünün tipine bağlıdır.
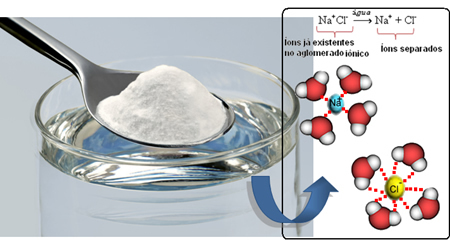
Örneğin NaCl (sodyum klorür - sofra tuzu) suda çok çözünür ve 1 L suda 20ºC'de bu tuzun 360 gramına kadar çözünür hale getirebiliriz. Ancak aynı hacim, sıcaklık ve basınç koşulları altında çözücü benzine dönüştüğünde tuz çözünmez.
Bir maddenin çözünürlüğü neden bir çözücüden diğerine bu kadar çok değişir?
Faktörlerden biri, polarite katılan bileşiklerdendir. Alıntılanan örnekte, biz tuz polar, su polar ve benzin polar değildir. Tuz, sodyumun kesinlikle klora elektron vererek Na iyonları oluşturduğu iyonik bağlarla bağlanan sodyum (Na) ve klor (Cl) atomlarından oluşur.+ ve Cl-. Bu iyonlar zıt yüklere sahip olduklarından birbirlerini çekerler ve bir arada tutarlar (Na+Cl-).

Bu bize, bileşiğin elektrik yükünde bir fark olduğu için tuzun gerçekten polar olduğunu, her iyonik bağın polar olduğunu gösterir.
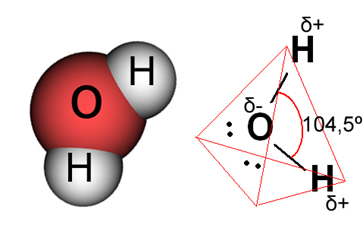
Su durumunda, mevcut bağ, iki hidrojen atomunun elektronları bir oksijen atomuyla paylaştığı kovalenttir. Su molekülünün iki dipolü vardır; oksijen kısmen negatif yüke ve hidrojen kısmen pozitif yüke sahiptir (δ- O ─ H δ+). Ancak bu dipoller birbirini yok etmez, çünkü su molekülü 104.5º'lik bir açıyla buluşur, bu da molekül boyunca dağılımın ve yükün düzgün olmadığını gösterir. Molekülün oksijen atomunda daha büyük bir negatif yük yoğunluğu vardır. Bu bize su molekülünün gerçekten polar olduğunu gösterir.
Şimdi durma... Reklamdan sonra devamı var ;)
Yani tuzu suya karıştırdığımızda tuzun pozitif kısmı olan Na katyonlarıdır.+, suyun oksijen olan negatif kısmı ve tuzun negatif kısmı (Cl anyonları) tarafından çekilir.-) suyun pozitif kısmı tarafından çekilir (H+). Sonuç olarak, birlik Na+Cl- parçalanır, tuzu suda çözer.
Benzin ise polar olmayan, yani benzinin elektrik yükünün dağılımı eşit olan farklı hidrokarbonların karışımından oluşur. Böylece tuz iyonlarının benzinle etkileşimi olmaz ve çözünmez.
Bu ve benzeri durumlar bizi şu sonuca götürür:

Bununla birlikte, bu genel bir kural olarak kabul edilemez, çünkü polar çözücülerde iyi çözünen polar olmayan çözünenlerin birçok durumu vardır ve bunun tersi de geçerlidir. Bu nedenle, bunun neden olduğunu anlamak için başka bir faktörü göz önünde bulundurmalıyız: moleküller arası kuvvet çözücü ve çözünenden.
Metinde bununla ilgili yasa: "Maddelerin Moleküller Arası Mukavemet ile Çözünürlüğü Arasındaki İlişki”.
Jennifer Foğaça tarafından
Kimya mezunu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bakmak:
FOGAÇA, Jennifer Rocha Vargas. "Maddelerin polaritesi ve çözünürlüğü arasındaki ilişki"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm. 27 Temmuz 2021'de erişildi.

