NS yanma reaksiyonları günlük hayatımızın birçok alanında bulunurlar. Örneğin, enerji üretiminin ana kaynakları, diğerleri arasında etanol, benzin, odun kömürü gibi belirli yakıtların yakılmasından veya yakılmasından kaynaklanmaktadır. Ayrıca, hayatta kalmak ve iş yapmak için ihtiyaç duyduğumuz enerji, yediğimiz yiyecekleri “yaktığımızda” hücrelerimizde meydana gelen yanma reaksiyonlarının bir sonucudur.
Fakat bir yanma reaksiyonunun olması için ne gerekir?
Üç şeye ihtiyaç var:
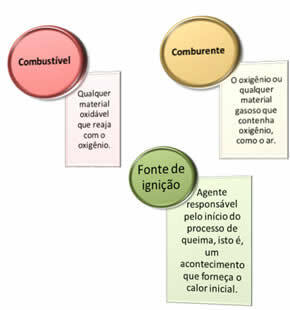
Bu üç faktörü oluşturan ateş üçgeniçünkü yanma reaksiyonu başladığında, açığa çıkan enerji reaksiyonu sürdürür ve yakıt, oksitleyici veya ısı (serbest kalan enerji) bitene kadar devam etmesine izin verir. Bu demektir ki bir Zincirleme tepki.
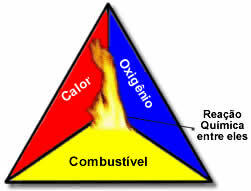
Örneğin ormanda biri yanan sigarayı atarsa yangın çıkar (yanma reaksiyonu). Bu durumda, çalı bu yakıt, Ö havada bulunan oksijen atmosferik oksitleyici bu sigara yanan oldu ateşleme kaynağı. Bu yanma, üç faktörden biri ortadan kalkana kadar devam eder. İtfaiyeciler su atarsa, ısı ortadan kalkacaktır. Ancak bu yanmayı durdurmak için hiçbir şey yapılmasa bile bir noktada yani yakıt (orman) bittiğinde bitecektir.
Daha önce belirtildiği gibi, bu reaksiyonlarda ısı açığa çıkar, dolayısıyla yanma ekzotermik bir reaksiyondur. Bununla birlikte, bu tür bir reaksiyon eksik yanmadır. Nedenini anlamak için tam ve eksik yanma arasındaki farkı görün:
Tam yanma:
Organik bileşikleri yakıt olarak analiz ederek şunları yapmalıyız:
| NS tam yanma karbon zinciri kırıldığında ve karbon zincirindeki tüm karbon atomları tamamen oksitlendiğinde ortaya çıkar. |
| Sen şekillendirilmiş ürünler hidrokarbonlar tarafından olacak CO2 (karbondioksit) ve H2Ö (Suçlu). |
Benzinin bileşenlerinden biri olan izoktanın tam yanmasını gözlemleyin.
C8H18 (g) +25/2 O2 (g) → 8 CO2(g) + 9 saat2Ö(1)
eksik yanma
| Bu durumda, yeterli oksitleyici, yani tüm yakıtı yakmak için yeterli oksijen yoktur. |
| Böylece oluşan ürünler CO (karbon monoksit) ve H2Ö. |
Bununla birlikte, aynı izoktan yanmasını şimdi tam olarak gözlemleyin:
C8H18 (g) + 17/2 O2(G) → 8 CO (G) + 9 saat2Ö(1)
Ormanların yakılması buna bir örnektir, çünkü ortaya çıkan emisyonlar CO ve kurum (C) gibi belirli maddelerin yanı sıra kül ve diğer basit ve karmaşık organik bileşiklerden oluşur. Azot oksit, ozon ve aldehitler de havadaki diğer bileşenlerin varlığından dolayı ikincil reaksiyonlar sonucu oluşabilmektedir.
C8H18 (g) + 9/2 O2 (g) → 8C (G) + 9 saat2Ö(1)
Jennifer Foğaça tarafından
Kimya mezunu
Brezilya Okul Takımı
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm

