Organik bileşikler, düz yapısal formül, basitleştirilmiş veya yoğunlaştırılmış yapısal formül veya kısa çizgi formülü gibi çeşitli şekillerde temsil edilebilir. Bununla birlikte, en basit temsil moleküler formül aracılığıyladır.

Böylece, yukarıda belirtilen diğer formüllere dayanarak organik bileşiklerin moleküler formülünün nasıl belirleneceğini görelim.
1. Düz Yapısal Formül sayesinde:bu formül, molekül içindeki atomların düzenini veya düzenini gösterir. Örneğin, benzinde bulunan hidrokarbonlardan birinin düz yapısal formülü aşağıdadır.

Bu formülde tüm atomların ve aralarındaki mevcut tüm bağların gösterildiğine dikkat edin. Şimdi, Bu bileşiğin moleküler formülünü belirlemek için, her bir elementin atom sayısını saymanız ve söz konusu elementin sağ alt tarafına bir indeks yerleştirmeniz yeterlidir.
Vurgulanması gereken önemli bir husus, organik bileşiklerin moleküler formülünü her zaman karbon elementinden başlatırız, çünkü bu maddelerin ana bileşenidir. Örneğe bakın:
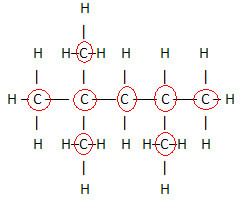
8 karbon olduğu için moleküler formülü şöyle yazmaya başlıyoruz: C8
Bu formülü tamamlamak için hidrojen miktarını sayıyoruz:
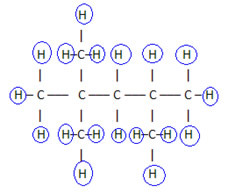
bu nedenle, senin Moleküler formül é C8H18.
2. Basitleştirilmiş veya yoğunlaştırılmış yapısal formül aracılığıyla: bu tip formülde, hidrojen miktarı kısaltılmıştır. Örneğin, benzinde bulunan molekül için aynı formüle bakın, şimdi yoğunlaştırılmış bir formda:
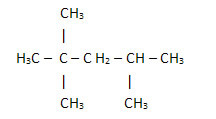
Bu şekilde hidrojen miktarını saymak daha da kolaydır, sadece (3 +3+ 3 +2 +1 +3 +3 = 18) indekslerini ekleyin.
Ama şimdi pamuk, soya fasulyesi, ayçiçeği gibi sebzelerde bulunan linoleik asidin yoğunlaştırılmış yapısal formülüne bakalım. ve boya ve verniklerde kullanılan:
H3C─CH2CH2CH2CH2CH=CH─CH2CH=CH─CH2CH2CH2CH2CH2CH2CH2─COOH
Karbon, hidrojen ve oksijen miktarını sayarak, aşağıdakilere sahibiz: Moleküler formül linoleik asit: C18H32Ö2.
3. İnme formülü ile: bu formül, C, CH, CH gruplarını atladığı için organik bileşiklerin nasıl temsil edileceğini daha da basitleştirir.2 ve CH3.
Bir örnek linoleik moleküldür, nasıl göründüğüne bakın:

Önce karbon miktarını sayalım, bu formülde karbonlar arasındaki her bağın tire ile temsil edildiğini hatırlayalım. Böylece uçlar ve iki bükülme noktası karbon atomlarına karşılık gelir.
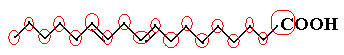
Böylece sahibiz: C18
Şimdi, hidrojen miktarını saymak için, karbonlar ve hidrojenler arasındaki bağların ima edildiğini hatırlamamız gerekir, çünkü karbonun dört bağ yaptığı bilinmektedir; bu nedenle, eksik olan bağların miktarı, o elemente bağlı hidrojen miktarıdır.
Aşağıdaki açıklamalara bakın:
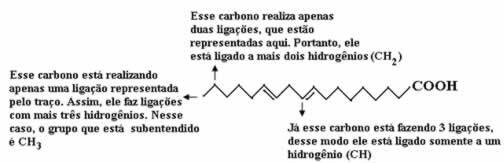
Böylece hidrojen miktarı: 32 olacaktır.

Oksijen miktarını saymak oldukça basittir, çünkü sadece iki tane vardır. Beri Moleküler formül é: C18H32Ö2.
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm
