Bir polar bileşik (veya madde) farklı elektron yoğunluklarına sahip iki bölgeye sahip olan bölgedir. Bu bölgelerden biri pozitif karaktere (beyaz alan), diğeri ise negatif karaktere (sarı alan) sahiptir.

Bir polar bileşikte farklı yük bölgelerinin temsili
Belli olup olmadığını bilin kompozit polardır molekülleri arasındaki etkileşimi destekleyen moleküller arası kuvvetin türünü bilmek anlamına gelir. diğer maddelerin moleküllerinin yanı sıra çözünürlükleri ve erime noktaları hakkında varsayımlar yapmak ve kaynamak.
Örneğin: çözünürlük ile ilgili olarak, polar bileşikler polar bileşiklere çözülme konusunda iyi bir yeteneğe sahiptir. Moleküller arası kuvvetlere gelince, duruma bağlı olarak, polar bileşikler kuvvetlerle etkileşime girebilir. kalıcı dipol veya hidrojen bağları (daha yüksek erime noktaları ve kaynamak).
İşte bir bileşiğin polar olup olmadığını belirlemenin iki pratik yolu.
Bulut sayısı ve ligand sayısı aracılığıyla polaritenin belirlenmesi
olup olmadığını belirleyebiliriz. kompozit polardır
merkez atoma bağlı eşit atomların sayısı ile o merkezi atomdaki elektron bulutlarının sayısı arasındaki ilişki ile.Not: Bir elektron bulutu, iki atom arasındaki herhangi bir kimyasal bağ veya bir atomun değerlik kabuğundan bir bağa katılmayan bir çift elektrondur.
Merkez atomda bulunan bulutların sayısı, o merkez atomdaki eşit ligandların sayısından farklıysa, polar bir bileşiğe sahibiz. Daha iyi anlamak için aşağıdaki örnekleri izleyin:
1. Örnek: Hidrosiyanik Asit Molekülü
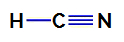
Hidrosiyanik asidin yapısal formülü
Hidrosiyanik asitte, merkezi atom, içinde dört elektron bulunan karbondur. değerlik katmanı periyodik tablonun IVA ailesine ait olduğu için. Karbon nasıl tek bir bağ yapıyor (her atomdan bir elektronla iki elektronu paylaşıyor) dahil) hidrojen ve nitrojen ile üçlü bir bağ ile atomda bağ yapmayan elektronlar yoktur. merkezi.
Böylece hidrosiyanik asitte iki elektronik bulut (bir tek bağ ve bir üçlü bağ) ve diğerine eşit bir ligand bulunur. Bu nedenle, bir polar bileşik.
2. Örnek: Amonyak molekülü (NH3)
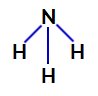
Amonyak yapısal formülü
Amonyakta, merkezi atom, periyodik tablonun VA ailesine ait olduğu için değerlik kabuğunda beş elektrona sahip olan nitrojendir. Azot tek bir bağ yaptığından (bir elektron ile iki elektronun paylaşılması) dahil olan her atom) her hidrojen atomuyla, beş elektronundan ikisi bağlara katılmaz.
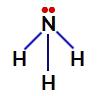
Amonyakta azot bağlamayan elektronlar
Böylece, amonyakta dört elektron bulutu (üç tekli bağ ve bağlanmayan elektron çifti) ve üç eşit ligand (üç hidrojen) vardır. Yani bir polar bileşik.
Bir bileşiğin dipol moment vektörü aracılığıyla polaritenin belirlenmesi
olup olmadığını belirleyebiliriz. kompozit polardır analizi yapılarak elde edilen dipol moment vektörü yapısal formülünde dikkate alınarak, Moleküler geometri ve farkı elektronegatiflik katılan atomlar arasında
Not: Elementlerin azalan elektronegatiflik sırası: F > O > N > Cl > Br > I > S > C > P > H.
Molekülde bulunan vektörlerin toplamı sıfırdan farklı olduğunda, bileşik polar olacaktır. Daha iyi anlamak için aşağıdaki örnekleri izleyin:
1. Örnek: triklorometan molekülü
Triklorometan sunan bir bileşiktir dört yüzlü geometri, aşağıdaki yapısal formülünde görebileceğimiz gibi:

Triklorometanın yapısal formülü
Polar bir bileşik olup olmadığını anlamak için öncelikle dipol moment vektörlerini (hangi atomun diğerinden daha kararlı olduğunu gösteren oklar) aşağıdaki örnekte olduğu gibi yapısal olana yerleştirmemiz gerekir:
Not: Klor, karbondan daha elektronegatif bir elementtir. Buna karşılık, karbon hidrojenden daha elektronegatif bir elementtir.
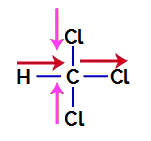
Triklorometanda Dipol Moment Vektörleri
Pembe renkli vektörler, aynı yöne (dikey) ve zıt yönlere (yukarı ve aşağı) sahip oldukları için +x ve -x ile temsil edilebilir. Kırmızı renkli vektörler, aynı yöne ve aynı yöne sahip oldukları için +x ile temsil edilir. Böylece, elde edilen dipol moment vektörü (vektörlerin toplamı) şu şekilde temsil edilir:
μr = (+x) + (-x) + (+x) + (+x)
μr = +X – x + x + x
μr = 2x
Elde edilen dipol moment vektörü sıfır olmadığı için, polar bileşik.
2. Örnek: su molekülü
Su sunan bir bileşiktir açısal geometri, aşağıdaki yapısal formülünde görebileceğimiz gibi:
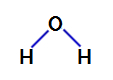
Suyun yapısal formülü
Polar bir bileşik olup olmadığını anlamak için öncelikle dipol moment vektörlerini (hangi atomun diğerinden daha kararlı olduğunu gösteren oklar) aşağıda gösterildiği gibi yapıya yerleştirmemiz gerekir:
Not: Oksijen, hidrojenden daha elektronegatif bir elementtir.
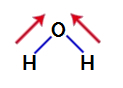
sudaki dipol moment vektörleri
Suyun yapısındaki iki vektör çapraz olarak çapraz olduğu için paralelkenar kuralını kullanmalıyız. Bu kuralda, vektörlerin tabanlarını bağladığımızda, aşağıdaki modelde olduğu gibi (önceden kullanılan ikisinin yerini alan) bir sonuç vektörünün oluşturulmasına sahibiz:
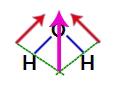
Suyun yapısal formülünde elde edilen vektör
Su molekülü tek bir vektöre sahip olduğundan, elde edilen dipol moment vektörü sıfır değildir, yani elimizde bir polar bileşik.
Benden Diogo Lopes Dias
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm


