KP belirlemek için kullanılan kısaltmadır. denge sabiti Kısmi basınçlar açısından. Bu sabit, örneğin atm birimindeki bir dengenin gaz halindeki katılımcılarının değerleri ile çalışır.

Gaz halindeki bileşenlerle kimyasal reaksiyonu temsil eden denklem
Bu denklemde, tüm katılımcılar gaz halindedir, dolayısıyla katılan bir gazın bir karışımdaki kısmi basınç, pX kısaltması ile temsil edilir.
Kimyasal denge denklemini (konsantrasyon açısından) kurarken, ürünler paya ve reaktanlar paydaya yerleştirilmelidir:
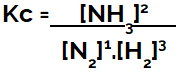
Amonyak oluşumu dengesinin Kc ifadesi
ifadesi basınç cinsinden denge sabiti (Kp) kalıbını takip eder kcyani, reaktiflerin kısmi basınçları paydada ve ürünlerin kısmi basınçları payda konumlandırılır:
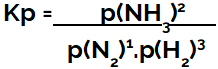
Amonyak oluşumu dengesinin Kp ifadesi
Gözlem: Reaksiyon denklemi ise kimyasal denge herhangi bir gazlı katılımcıyı sunmayın, otomatik olarak sunulmayacaktır. KP.
Örnek: (PUC-MG) Reaksiyon için: 2 CO(G) + O2(g)? 2 CO2(g), CO'nun kısmi basınçları(G) bu2(g) dengede sırasıyla 0,2 atm ve 0,4 atm'dir. Toplam sistem basıncı 1,4 atm'dir. Değeri KP tepkime için:
a) 56.2
b) 40.0
c) 35.6
d) 28.4
e) 25.6
Tatbikat tarafından sağlanan veriler şunlardır:
Karbon monoksit kısmi basıncı (pCO) = 0,2 atm;
Kısmi karbon monoksit basıncı (pO2) = 0,4 atm;
Toplam basınç =1.4 atm;
Bu sistemin Kp'sini belirlemek için aşağıdaki adımları uygulamamız gerekir:
1. Adım: Karbon monoksitin (pCO) kısmi basıncını belirleyin2).
Bunun için toplam basıncın (pt) tüm kısmi basınçların toplamı olduğunu unutmayın:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0.8 atm
2. Adım: Egzersizin Kp'sini belirleyin.
Bunun için sadece denge sabiti Kp'nin ifadesindeki değerleri kullanın:
Kp = (pCO2)2
(pCO)2.(toz2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Benden Diogo Lopes Dias
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm
