Fransız kimyager Henri Louis Le Chatelier, bir değişikliğe maruz kaldığında kimyasal sistemin dengedeki tepkisini tahmin eden en iyi bilinen kimya yasalarından birini yarattı.
Çalışmalarının sonuçlarıyla, kimyasal denge için aşağıdakileri belirten bir genelleme formüle etti:
"Dış bir faktör dengedeki bir sisteme etki ettiğinde, her zaman uygulanan faktörün etkisini en aza indirme anlamında hareket eder."
Bir kimyasal sistemin dengesi bozulduğunda, sistem bu bozukluğu en aza indirecek ve kararlılığı yeniden sağlayacak şekilde hareket eder.
Bu nedenle, sistem şunları sunar:
- ilk denge durumu.
- bir faktörün değişmesiyle "dengesiz" bir durum.
- değişime karşı çıkan yeni bir denge durumu.
Kimyasal dengeyi etkileyebilecek dış rahatsızlık örnekleri şunlardır:
| faktör | rahatsızlık | Yapıldı |
|---|---|---|
| konsantrasyon | Artırmak | maddeyi tüket |
| Azaltmak | madde üretilir | |
| Basınç | Artırmak | En küçük hacme gider |
| Azaltmak | En yüksek hacme gider | |
| Sıcaklık | Artırmak | Isıyı emer ve denge sabitini değiştirir |
| Azaltmak | Isı yayar ve denge sabitini değiştirir | |
| katalizör | mevcudiyet | Reaksiyon hızlanır |
Bu ilke, reaksiyonların manipüle edilebildiği ve süreçleri daha verimli ve ekonomik hale getirebildiği için kimya endüstrisi için büyük önem taşımaktadır.
Bunun bir örneği, Le Chatelier ilkesini kullanarak, atmosferik nitrojenden amonyak üretimi için ekonomik bir yol oluşturan Fritz Haber tarafından geliştirilen süreçtir.
Daha sonra, Chatelier yasasına göre kimyasal dengeye ve bozulmaların onu nasıl değiştirebileceğine bakacağız.
hakkında daha fazla bilgi:
- kimyasal denge
- İyonik Denge
- Asit-baz göstergeleri
Konsantrasyon etkisi
Kimyasal bir denge olduğunda, sistem dengelenir.
Dengedeki sistem şu durumlarda bir bozulmaya maruz kalabilir:
- Reaksiyonun bir bileşeninin konsantrasyonunu arttırırız.
- Reaksiyonun bir bileşeninin konsantrasyonunu düşürürüz.
Kimyasal reaksiyona bir madde eklediğimizde veya çıkardığımızda, sistem değişime karşı çıkıyor, o bileşiği tüketiyor veya daha fazlasını üretiyor, böylece denge yeniden kuruluyor.
Reaktanların ve ürünlerin konsantrasyonları yeni bir dengeye uyum sağlamak için değişir, ancak denge sabiti aynı kalır.
Misal:
Dengede:
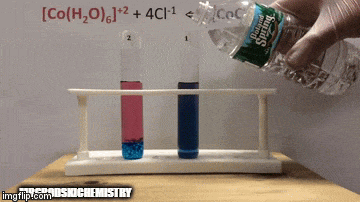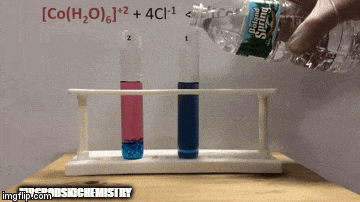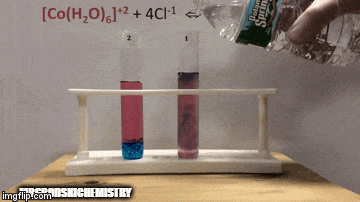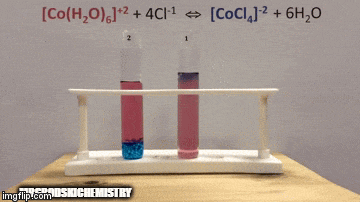
Reaksiyon daha yüksek konsantrasyonda ürünlere sahiptir, çünkü çözeltinin mavi renginden [CoCl kompleksinin4]-2 hakimdir.
Su da doğrudan reaksiyonun bir ürünüdür ve çözeltideki konsantrasyonunu arttırdığımızda, sistem değişime karşı çıkarak suyun ve kompleksin reaksiyona girmesine neden olur.
Denge sola, reaksiyon yönünün tersine kaydırılır ve çözeltinin rengini değiştirerek reaktanların konsantrasyonunun artmasına neden olur.
sıcaklığın etkisi
Dengedeki sistem şu durumlarda bir bozulmaya maruz kalabilir:
- Sistem sıcaklığında bir artış var.
- Sistem sıcaklığında bir düşüş var.
Bir kimyasal sisteme enerji eklerken veya çıkarırken, sistem değişime karşı çıkar, enerjiyi emer veya serbest bırakır, böylece denge yeniden kurulur.
Sistem sıcaklığı değiştirdiğinde, kimyasal denge aşağıdaki gibi değişir:
Sıcaklık arttırılarak endotermik reaksiyon tercih edilir ve sistem ısıyı emer.
Sıcaklık düşürüldüğünde, ekzotermik reaksiyon tercih edilir ve sistem ısıyı serbest bırakır.
Misal:
Kimyasal dengede:
Bu sistemi içeren deney tüpünü sıcak su dolu bir behere koyduğumuzda, sistemin sıcaklığı artar ve denge daha fazla ürün oluşturmak üzere değişir.

Bunun nedeni, doğrudan reaksiyonun endotermik olması ve sistemin ısıyı emerek yeniden kurulmasıdır.
Ayrıca, sıcaklık değişimleri denge sabitlerini de değiştirir.
Basınç etkisi
Dengedeki sistem şu durumlarda bir bozulmaya maruz kalabilir:
- Toplam sistem basıncında bir artış var.
- Toplam sistem basıncında bir azalma var.
Bir kimyasal sistemin basıncını arttırdığımızda veya azalttığımızda, sistem değişime karşı çıkar ve sırasıyla daha az veya daha büyük hacim anlamında denge, ancak denge sabitini değiştirmez.
Sistem hacmi değiştirdiğinde, uygulanan basıncın etkisini aşağıdaki gibi en aza indirir:
Sisteme uygulanan basınç ne kadar büyük olursa, hacimde bir daralma olur ve denge, daha az mol sayısına doğru kayar.
Ancak basınç düşerse sistem genişler, hacmi artar ve reaksiyonun yönü en fazla mol sayısına sahip olana kayar.
Misal:
Vücudumuzun hücreleri kimyasal denge yoluyla oksijen alır:
Bu sistem, soluduğumuz havadaki oksijenin kanda bulunan hemoglobin ile temas etmesi ve oksijeni taşıyan oksi-hemoglobine yol açmasıyla kurulur.
Bir kişi bir dağa tırmandığında, ulaşılan irtifa ne kadar yüksek olursa, O'nun miktarı ve kısmi basıncı o kadar düşük olur.2 havada kalmış.
Vücutta oksijen taşıyan denge sola kayar ve oksi-hemoglobin miktarını azaltarak hücrelerin aldığı oksijen miktarını tehlikeye atar.
Bunun sonucu, ölüme bile yol açabilecek baş dönmesi ve yorgunluğun ortaya çıkmasıdır.
Vücut daha fazla hemoglobin üreterek tepki vermeye çalışır. Ancak bu, irtifa ayarı gerektiren yavaş bir işlemdir.

Bu nedenle Everest Dağı'na tırmanabilen insanlar, aşırı irtifaya en uygun olanlardır.
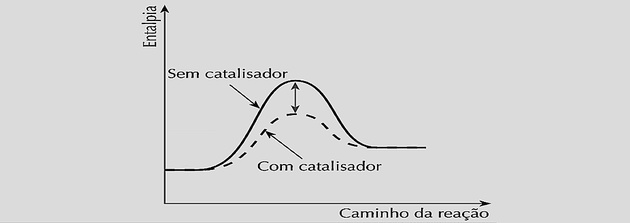
Katalizörler
Bir katalizörün kullanılması, hem doğrudan hem de ters reaksiyonda reaksiyon hızına müdahale eder.
Bir reaksiyonun meydana gelmesi için moleküllerin çarpışması ve etkili bir şekilde reaksiyona girmesi için minimum bir enerjiye ulaşması gerekir.
Katalizör, kimyasal sisteme girdiğinde, aktifleştirilmiş bir kompleks oluşturarak ve kimyasal dengeye ulaşmak için daha kısa bir yol oluşturarak bu aktivasyon enerjisini azaltarak etki eder.
Reaksiyon hızlarını eşit olarak artırarak, aşağıdaki grafiklerde görülebileceği gibi dengeye ulaşmak için gereken süreyi azaltır:
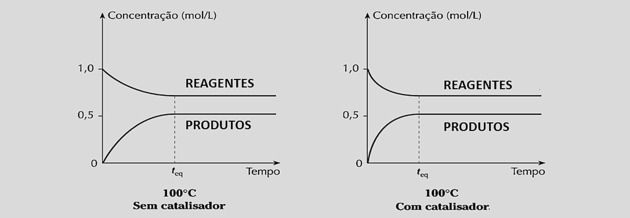
Bununla birlikte, katalizörlerin kullanılması, karışımın bileşimine müdahale etmediği için reaksiyon verimini veya denge sabitini değiştirmez.
amonyak sentezi
Azot bazlı bileşikler, diğerlerinin yanı sıra tarımsal gübrelerde, patlayıcılarda, ilaçlarda yaygın olarak kullanılmaktadır. Bu nedenle, NH amonyak gibi milyonlarca ton azot bileşiği üretilir.3, NH amonyum nitrat4ŞEHİR3 ve üre H2NCONH2.
Dünya çapında nitrojen bileşiklerine, özellikle de tarımsal faaliyetlere yönelik talep nedeniyle, Şili'nin NaNO güherçilesi3Azotlu bileşiklerin ana kaynağı, 20. yüzyılın başlarına kadar en çok kullanılan güherçile idi, ancak doğal güherçile mevcut talebi karşılayamazdı.
Atmosferik havanın, %70'ten fazla nitrojen N'den oluşan bir gaz karışımı olduğunu belirtmek ilginçtir.2. Ancak üçlü bağın kararlılığı nedeniyle yeni bileşikler oluşturmak için bu bağı kırmak çok zor bir süreç haline gelir.
Bu sorunun çözümü Alman kimyager Fritz Haber tarafından önerildi. Haber tarafından önerilen amonyak sentezi aşağıdaki kimyasal dengeyi getirir:
Endüstriyel olarak uygulanmak üzere, bu süreç Carl Bosch tarafından mükemmelleştirildi ve bugüne kadar nitrojenli bileşikler elde etmeye odaklanarak havadan nitrojeni yakalamak için en çok kullanılan yöntemdir.
Le Chatelier ilkesini kullanarak, kimyasal denge şu durumlarda artırılabilir:
H ekle2 ve sistemin değişime karşı çıkmasına ve bu reaktantın konsantrasyonunu düşürmek için tepki vermesine neden olur.
Böylece, H2 ve hayır2 daha fazla ürün üretmek ve yeni bir denge durumu yaratmak için aynı anda tüketilirler.
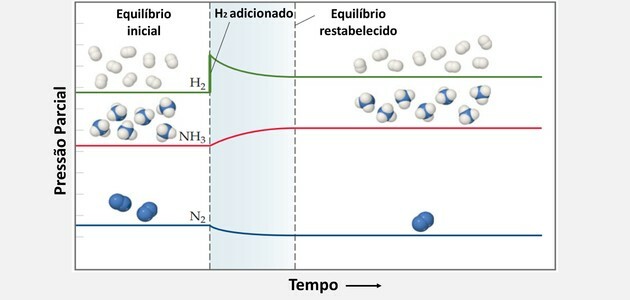
Aynı şekilde, daha fazla nitrojen eklenirken denge sağa kayar.
Endüstriyel olarak, denge, NH'nin sürekli olarak çıkarılmasıyla değiştirilir.3 Sistemin seçici sıvılaştırma yoluyla reaksiyon verimini artırarak, denge yeniden kurulacağından daha fazla ürün oluşturma eğiliminde olur.
Haber-Bosch sentezi kimyasal denge çalışmalarının en önemli uygulamalarından biridir.
Bu sentezin alaka düzeyi nedeniyle Haber 1918'de Nobel Kimya Ödülü'nü, Bosch ise 1931'de Nobel Ödülü'nü aldı.
Denge kaydırma egzersizleri
Artık kimyasal dengede meydana gelebilecek değişiklikleri nasıl yorumlayacağınızı bildiğinize göre, bilginizi test etmek için bu vestibüler soruları kullanın.
1. (UFPE) En uygun antasitler mide asidini çok fazla düşürmeyenler olmalıdır. Asitlikteki azalma çok fazla olduğunda, mide fazla asit salgılar. Bu etki “asit rövanşı” olarak bilinir. Aşağıdakilerden hangisi bu etki ile ilişkilendirilebilir?
a) Enerjinin korunumu yasası.
b) Pauli dışlama ilkesi.
c) Le Chatelier ilkesi.
d) Termodinamiğin birinci ilkesi.
e) Heisenberg'in belirsizlik ilkesi.
Doğru alternatif: c) Le Chatelier ilkesi.
Antasitler, midenin pH'ını artırarak ve dolayısıyla asitliği azaltarak çalışan zayıf bazlardır.
Asitlikteki azalma, midede bulunan hidroklorik asidin nötralize edilmesiyle gerçekleşir. Ancak mide asidik bir ortamda çalıştığı için asitliği çok fazla azaltarak vücutta bir dengesizlik oluşturabilir.
Le Chatelier ilkesinin belirttiği gibi, dengedeki bir sistem bir bozulmaya maruz kaldığında, bu değişime karşı bir muhalefet olacak ve böylece denge yeniden kurulacaktır.
Bu şekilde vücut daha fazla hidroklorik asit üretecek ve “asit rötuş” etkisi yaratacaktır.
Alternatiflerde sunulan diğer ilkeler şunlarla ilgilidir:
a) Enerjinin korunumu yasası: Bir dizi dönüşümde sistemin toplam enerjisi korunur.
b) Pauli dışlama ilkesi: bir atomda iki elektron aynı kuantum sayılarına sahip olamaz.
d) Termodinamiğin birinci ilkesi: Sistemin iç enerjisinin değişimi, ısı alışverişi ile yapılan iş arasındaki farktır.
e) Heisenberg Belirsizlik İlkesi: Herhangi bir anda bir elektronun hızını ve konumunu belirlemek mümkün değildir.
Dengedeki sistemle ilgili olarak, doğru bir şekilde ifade edilebilir:
a) bir katalizörün varlığı, karışımın bileşimini etkiler.
b) bir katalizörün varlığı denge sabitini etkiler.
c) Basınçtaki artış CH miktarını azaltır4(g).
d) Sıcaklıktaki artış denge sabitini etkiler.
e) Sıcaklıktaki artış CO miktarını azaltır(g) .
Doğru alternatif: d) Sıcaklıktaki artış denge sabitini etkiler.
Sıcaklık yükseltildiğinde endotermik olan doğrudan reaksiyon etkilenecektir, çünkü dengeyi yeniden kurmak için sistem enerjiyi emecek ve dengeyi sağa kaydıracaktır.
Dengeyi direkt yöne kaydırarak oluşan ürün miktarı artar.
Denge sabiti, ürünlerin konsantrasyonu ile doğru orantılıdır: Ürünlerin miktarı ne kadar büyükse, sabitin değeri de o kadar büyük olur.
O halde sıcaklıktaki artışın CO ve H miktarını arttırdığını gözlemleyebiliriz.2.
Basınçtaki artış, denge en düşük mol sayısına doğru kayarken, dengeyi ters reaksiyona kaydırır. Bununla birlikte, CH miktarı4 ve H2Artırılır.
Katalizör kullanımı, karışımın denge sabitine ve bileşimine müdahale etmez. Sadece dengeyi daha hızlı elde ederek hareket edecektir.
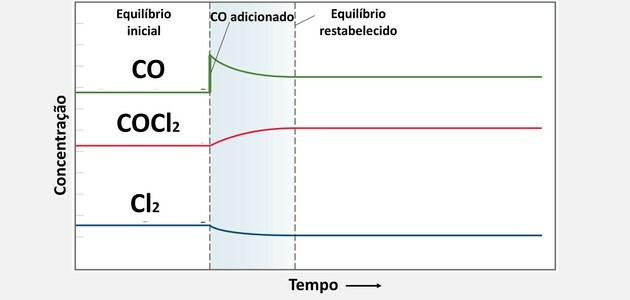
3. (UFC) COCl zehirli gazının etkisinin çalışmasında2, kimyasal bir silah olarak kullanıldığında, reaksiyona göre ayrışma süreci gözlenir:
Bir denge durumundan başlayarak, 0.10 mol CO ilave edildi ve sistem bir süre sonra yeni bir denge durumuna ulaştı. Yeni denge konsantrasyonlarının eskileriyle nasıl ilişkili olduğunu gösteren seçeneği seçin.
| [COCl2] | [CO] | [Şl.2] | |
| ) | yeni > eski | yeni > eski | yeni |
| B) | yeni > eski | yeni > eski | yeni > eski |
| ç) | yeni | yeni > eski | yeni |
| d) | yeni > eski | yeni | yeni |
| ve) | aynı | aynı | aynı |
Doğru alternatif:
| [COCl2] | [CO] | [Şl.2] | |
| ) |
Yeni bir madde eklendiğinde, konsantrasyonu arttıkça sistem dengeyi sağlamak için o maddeyi tüketir.
Bu tüketim, maddenin diğer bileşik ile reaksiyona girmesi ve böylece daha fazla ürün oluşması ile gerçekleşir.
Bu nedenle, CO konsantrasyonunu arttırdığımızda tüketim olacaktır, ancak tüketim noktasına kadar değil. Tüketimi başka biriyle birlikte gerçekleşeceğinden, başlangıç durumundaki konsantrasyondan daha düşük bileşen.
Zaten Cl konsantrasyonu2 eklenen CO miktarı ile reaksiyona girmesi gerektiğinden ilkinden daha küçük olur.
İki maddenin birleşmesinden COCl konsantrasyonu arttı2, oluşan ürün olduğu için.
Kimyasal dengedeki bu değişiklikler aşağıdaki grafikte görülebilir:
4. (UFV) Dengedeki bir kimyasal reaksiyonun deneysel çalışması, sıcaklık, ürünlerin oluşumunu desteklerken, basınçtaki artış, ürünlerin oluşumunu destekledi. reaktifler. Bu bilgiye dayanarak ve A, B, C ve D'nin gaz olduğunu bilerek, çalışılan denklemi temsil eden alternatifi işaretleyin:
| ) | ||
| B) | ||
| ç) | ||
| d) | ||
| ve) |
Doğru alternatif:
| ) |
Sıcaklık arttıkça, sistem dengeyi yeniden sağlamak için ısıyı emer ve bununla ∆H pozitif olan endotermik reaksiyonu destekler.
Sıcaklığı artırarak ürün oluşumunu desteklemeye karşılık gelen alternatifler: a, b ve d'dir.
Ancak basınç arttığında denge en küçük hacme, yani mol sayısı en az olana doğru kayar.
Reaksiyonun reaktanlara doğru hareket etmesi için, reaksiyonun bu yönünün ürünlere göre daha az sayıda mol olması gerekir.
Bu sadece ilk alternatifte gözlenir.
5. (UEMG) Aşağıdaki denklemler dengedeki sistemleri temsil eder. Basınç değişimiyle değişmeyen tek sistem nedir?
a) işletim sistemi2(g) + 1/2 O2(g) ⇔ SO3(g)
b) CO2(g) + H2(g) ⇔ CO(g) + H2Ö(g)
c) Hayır2(g) + 3 Saat2(g) ⇔ 2 NH3(g)
d) 2CO2(g) ⇔ 2 CO(g) + O2(g)
Doğru alternatif: b) CO2(g) + H2(g) ⇔ CO(g) + H2Ö(g)
Bir sistem toplam basıncı değiştirdiğinde, hacimdeki değişiklikle denge yeniden kurulur.
Basınç artarsa hacim azalır, denge en küçük mol sayısına kayar.
Öte yandan, basınç düştüğünde hacim artar ve denge daha fazla mol sayısına doğru kayar.
Ancak, aynı sayıda reaksiyona giren madde ve oluşan ürün mol olduğunda, hacim değişmediğinden dengeyi değiştirmenin bir yolu yoktur.
Her maddenin yanındaki stokiyometrik katsayılardan mol sayısını biliyoruz.
Bunu alternatif denklemde görebiliriz
b) CO2(g) + H2(g) ⇔ CO(g) + H2Ö(g)
1 mol CO2 1 mol H ile reaksiyona girer2 1 mol CO ve 1 mol H oluşturmak için2Ö.
Reaksiyonun her iki yönünde de 2 mol vardır, bu nedenle basınçtaki değişiklikler hacmi değiştirmez.
Hazırladığımız bu listede, yorumlanmış çözünürlükle birlikte kimyasal denge yer değiştirmesi hakkında daha fazla soruya göz atın: kimyasal denge egzersizleri.
Le Chatelier kimdi?