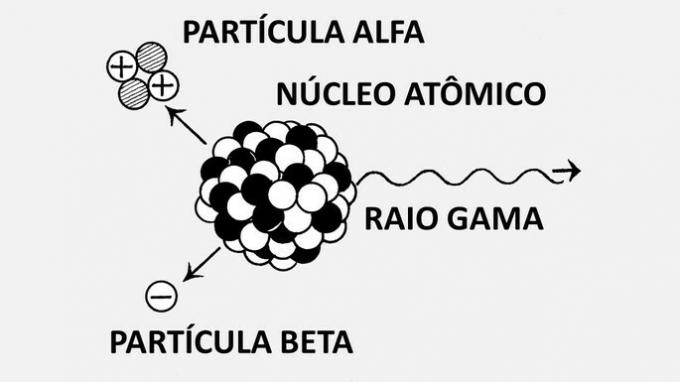
Atom, maddenin temel birimi ve kimliğini taşıdığı için kimyasal bir elementi tanımlayabilen en küçük fraksiyondur. Atom terimi Yunancadan türetilmiştir ve bölünemez anlamına gelir.
Nötron ve proton içeren bir çekirdek ile çekirdeği çevreleyen elektronlardan oluşur.
atom yapısı
Atom, küçük parçacıklar olarak da adlandırılır. atomaltı parçacıklars: elektronlar, protonlar ve nötronlar.
Atomun kütlesinin çoğu, küçük, yoğun bir bölge olan çekirdekte yoğunlaşmıştır. En büyük hacmi, elektronlar çekirdeğin etrafında dönerken, boş alanların olduğu bir yer olan elektrosferde bulunur.

elektronlar
Ö elektron negatif bir elektrik yüküne (-1) sahiptir ve 9.11 x 10 değerinde olduğu için neredeyse hiç kütlesi yoktur.-28 g ve çekirdek kütlesinden yaklaşık 1840 kat daha küçüktür. Atom çekirdeğinin etrafında çok hızlı dönen küçük parçacıklardır.
Atomun en dış bölgelerinde bulunan elektronlar, elektronların verilmesi, alınması veya paylaşılması yoluyla meydana gelen kimyasal bağların oluşumundan sorumludur.
protonlar
Ö proton elektronlar üzerindeki yük ile aynı mutlak değerde pozitif bir elektrik yüküne (+1) sahiptir. Bu şekilde, bir proton ve bir elektron elektriksel olarak birbirini çekme eğilimindedir.
Protonlar aracılığıyla kimyasal elementleri ayırt etmek mümkündür, çünkü bir elementin her atomunun çekirdeğinde belirli sayıda proton vardır. atomik numara.
nötronlar
Ö nötron hiç yükü yoktur, yani elektriksel olarak nötrdür. Protonlarla birlikte atomun tüm kütlesini (%99.9) taşıyan atom çekirdeğini oluşturur. Hem proton hem de nötron yaklaşık olarak 1.67 x 10 kütleye sahiptir.-24 g. Bu değer 1 μ atomik kütle birimini temsil eder.
Nötron, nükleer kuvvet elektronları ve protonları çekmesine neden olduğu için atom çekirdeğine stabilite sağlar.
Sadece hidrojen atomunun nötronu yoktur, sadece bir proton etrafında dönen bir elektrondan oluşur.
için aşağıdaki tabloyu kontrol edin. Öz atom altı parçacıklar hakkında bilgi.
| parçacık | Sembol |
Makarna (birim olarak atom kütlesi) |
Şarj etmek (birim olarak elektrik yükü - u.c.e) |
yer |
|---|---|---|---|---|
| Proton | +1 | çekirdek | ||
| Nötron | 0 | çekirdek | ||
| Elektron | -1 | elektrosfer |
Temel durumundaki bir atom elektriksel olarak nötrdür, çünkü proton sayısı elektron sayısına eşittir ve pozitif ve negatif zıt yükler birbirini yok eder.
Örneğin, sodyum (Na) atom numarası 11'dir, yani çekirdeği 11 protona sahiptir. Sonuç olarak, o elementin bir atomunun elektrosferinde 11 elektron vardır.
hakkında daha fazla bilgi edinin atomik yapı.
atom bileşimi
Gördüğümüz gibi atom, çekirdek adı verilen küçük ve yoğun bir merkezi bölgeden oluşur ve çevresinde bir Elektronların bulunduğu, elektronik katmanlara, enerji alt seviyelerine ve enerji alt seviyelerine bölünebilen elektrosfer atomik yörüngeler.
elektronik katmanlar
atom sunar enerji seviyeleriBir çekirdeğin etrafındaki yedi katmana karşılık gelen ve içlerinde onun etrafında dönen elektronlar bulunur. Katmanlar K, L, M, N, O, P ve Q olarak adlandırılır.

Aşağıdaki tabloda gösterildiği gibi, her kabuk belirli sayıda elektron içerebilir.
| Enerji seviyesi | elektronik katman | Maksimum elektron sayısı |
|---|---|---|
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | Ö | 32 |
| 6º | P | 18 |
| 7º | S | 8 |
Örneğin, helyum (He) atomunun atom numarası 2'dir ve bu nedenle çekirdeğinde 2 proton vardır. Sonuç olarak, atomun elektrosferinde, atomun ilk ve tek elektronik kabuğunda, birinci enerji seviyesine karşılık gelen K kabuğunda bulunan sadece 2 elektron vardır.
Enerji alt seviyeleri
Enerji seviyeleri, s, p, d, f ile temsil edilen alt seviyeleri barındırır. Her alt seviye, sırasıyla 2, 6, 10 ve 14 olan maksimum sayıda elektron barındırır.

Bu bilgi ile mümkün elektronik dağıtım bir atomun ve en dıştaki ve en enerjik elektronun yerini bilir.
Misal: Azot (N)
Atom Numarası: 7
Elektronik dağıtım: 1s2 2s2 2p3
Azot atomunun iki enerji seviyesi vardır, K ve L ve 7 elektronu s ve p alt seviyelerini işgal eder.
K: s2 = 2 elektron
L: s2 + p3 = 5 elektron
L kabuğunun 8 elektrona kadar içerebileceğini, ancak nitrojen atomunda bu kabukta sadece 5 elektron bulunduğunu unutmayın.
atomik yörüngeler
Yörüngeler, bir elektronik kabukta (K, L, M, N, O, P, Q) bir enerji alt seviyesi (s, p, d, f) içinde bir elektron bulma olasılığı en yüksek olan bölgeyi karakterize eder.
- s alt seviyesi: 2 elektrona kadar tutan 1 yörüngeye sahiptir
- p alt seviyesi: 6 elektrona kadar ev sahipliği yapan 3 yörüngeye sahiptir
- Alt düzey d: 10 elektrona kadar ev sahipliği yapan 5 yörüngeye sahiptir
- Alt düzey f: 14 elektrona kadar barındıran 7 yörüngeye sahiptir

Örnek olarak nitrojeni tekrar kullanmak ve 7 elektronunu atomik orbitallere dağıtmak:

atom türleri
Proton, nötron ve elektron sayısını gözlemleyerek atomları karşılaştırabilir ve onları sınıflandırabiliriz. izotoplar, izobarlar ve izotonlar.
Bir kimyasal element, aynı sayıda protona sahip bir atom grubu olarak tanımlanabilir. Bu atomlara aynı atom numarasına ve farklı kütlelere sahip oldukları için izotop denir.
Örneğin doğada hidrojen (H) elementinin 3 izotopu vardır: protium , döteryum
ve trityum
.
Farklı kimyasal elementlerin atomları, farklı atom numaralarına ve kütlelere sahip olduklarında, ancak aynı sayıda nötrona sahip olduklarında izoton olarak sınıflandırılabilir.
İzobarlar, farklı elementlerin atomlarıdır, yani farklı bir atom numarasına, ancak aynı kütle numarasına sahiptirler.
hakkında daha fazla bilgi edinin izotoplar, izobarlar ve izotonlar.
Atom modelleri (atomik modeller)
Yunan filozof Aristoteles (384 a. Ç. - 322 a. C) Toprak, hava, ateş ve su elementlerinden tüm maddelerin yapısını açıklamaya çalışmıştır.
Demokritos (546 a. C - 460 a. C), bir Yunan bilim adamı ve matematikçi, parçacıkların küçüklüğünün bir sınırı olduğu fikrini formüle etti. Artık bölünemeyecek kadar küçüleceklerini söyledi. Bu parçacığa "atom" adını verdi.
19. yüzyılın büyük bir bölümünde, Dalton Atom Modeli, eskilerin düşüncesinin çok ötesine geçen atom teorisini öneren İngiliz bilim adamı.
Bu teori, tüm maddelerin atom adı verilen ve bilardo topları gibi olacak küçük bölünmez parçacıklardan oluştuğunu söyledi. Maddenin yapısı üzerine yapılan çalışmalar ilerledikçe, atomun atom altı denilen diğer küçük parçacıklardan oluştuğu keşfedildi.
Elektronun keşfiyle, Thomson Atomu, yüzeyinde gömülü negatif yüklü elektronlarla pozitif bir küre olarak tanımlayan kütle pudingi olarak bilinen modeli formüle etti.
Fizikçi deneyler yoluyla Rutherford atomun son derece küçük, pozitif bir çekirdeğin etrafında boşluklara ve elektronlara sahip olduğunu buldu. Böylece Rutherford, atomu temsil etmek için nükleer modeli önerdi.
Bohr Rutherford tarafından önerilen modeli, elektronların çekirdeğin etrafında rastgele değil, belirli yörüngelerde döndüğünü bularak geliştirdi. Bu model planetaryum olarak tanındı.
Ayrıca şunları okuyun:
- atom modelleri
- Thomson Atom Modeli
- Bohr'un atom modeli
- Rutherford Atom Modeli
- Atom modellerinin evrimi