Ana bileşeni lityum olan piller veya pillerin özelliklerinden biri, lityum şimdiye kadar keşfedilen en az yoğun metal olduğundan, çok hafif olmaları gerçeğine sahiptir. Size bir fikir vermek için, bu gümüşi beyaz metal, olduğundan iki kat daha yoğun olduğu için suda yüzer. Bunun nedeni, lityumun yalnızca üç protona ve üç nötrona sahip olmasıdır.
Biri olarak adlandırılan iki ana lityum pil türü vardır. lityum iyot pil. Öncelikle kullanım için geliştirilmiştir. kalp pili, çok hafif olduğundan, güvenli olduğundan (hermetik olarak kapalı olduğu için gaz çıkarmaz), iyi bir dayanıklılık (yaklaşık 8 ila 10 yıl), 2,8 V voltaj ve yüksek şarj yoğunluğu (0,8 s/cm3).
Elektrotlar, elektrik akımının geçişine izin veren kristal bir lityum iyodür tabakasıyla ayrılan lityum ve bir iyot kompleksinden oluşur. Ö metalik lityum gibi çalışır anot Bu hücrenin, yani oksitlenen, elektron kaybeden negatif kutuptur. zaten katot, elektronları alan, azaltan pozitif kutup, iyot kompleksi.
Elektrotlarda meydana gelen yarı reaksiyonlara ve bu tip hücrenin global reaksiyonunu temsil eden denkleme bakın:
Anot Yarım Reaksiyonu: 2 Li(ler) →2 okudum+(ler) + 2e-
Katot Yarı Reaksiyonu: 1 I2(ler) + 2e-→2 ben-(ler)
Küresel Reaksiyon: 2 Litre(ler) + 1 ben2(ler) →2 LiI(ler)
Lityum iyot piller, aşağıdaki şekilde gösterildiği gibi çok küçük madeni paralar şeklindedir:

Diğer hücre veya pil türü, lityum iyon. Çalışması lityum iyonlarının (Li ) hareketine dayalı olduğu için bu ismi alır.+). Şu anda yaygın olarak kullanılmaktadır cep telefonu pilleri ve potansiyeli 3,0 ile 3,5 V arasında değişmektedir.

Anot ve katot, lityum iyonlarının yerleştirildiği boşluklara sahip tabakalar gibi düzlemlerde düzenlenmiş atomlardan oluşur. Ö anot bakır metali ile grafit tarafından oluşturulur ve iyonlar altıgen karbon yapılarının düzlemlerinde araya girerek aşağıdaki maddeyi oluşturur: okuyÇ6.zaten katot lamelli bir yapıya sahip bir oksit içinde aralanmış lityum iyonları tarafından oluşturulur (okuxCoO2).
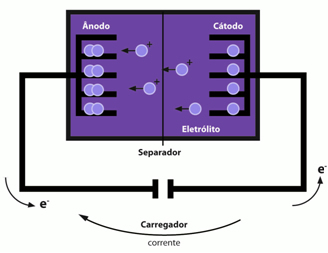
Böylece, lityum iyonlarının anottan ayrıldığı ve susuz bir çözücüden katoda göç ettiğine sahibiz.
Anot Yarı Reaksiyonu: LiyÇ6(lar) → y Li + Ç6+y-
Katot Yarı Reaksiyonu: LixCoO2(ler) + y oku+(ler) + y ve- → okudumx+yCoO2(ler)
Küresel Reaksiyon: LiyÇ6(lar) + okuxCoO2 → Ç6(ler) +okux+yCoO2(ler)
Bu piller, lityum iyonlarının ters yönde, yani oksitten grafite geçişine neden olan harici bir elektrik akımı kullanılarak yeniden şarj edilebilir.

Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/pilhas-baterias-litio.htm
