Çözünen ve çözücü, kimyasal çözelti adı verilen homojen bir karışımın iki bileşenidir.
- çözünen: çözücü içinde dağılan maddedir. Çözülecek olan maddeye karşılık gelir ve genellikle çözeltide daha az miktarda bulunur.
- çözücü: yeni bir ürün oluşturmak için çözünenin çözüleceği maddedir. Çözeltide kendisini daha fazla miktarda sunar.
Çözünen (dağılmış) ve çözücü (dağıtıcı) arasındaki çözünme, molekülleri arasındaki etkileşimler yoluyla gerçekleşir.
Bir çözeltinin bu iki bileşeni arasındaki fark, çözünenin çözünecek madde olması ve çözücünün çözünmeyi gerçekleştirecek madde olmasıdır.
En iyi bilinen çözücü sudur. evrensel çözücü. Bunun nedeni, çok miktarda maddeyi çözme yeteneğine sahip olmasıdır.
Çözünen ve Çözücü Örnekleri
Bazı kimyasal çözelti örneklerine bakın ve her birinin çözünenlerini ve çözücülerini keşfedin:
su ve tuz
- Çözünen: Sofra tuzu - Sodyum klorür (NaCl)
- Çözücü: Su
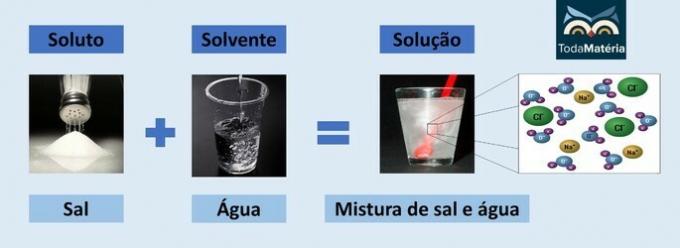
İyonik bir bileşik olduğundan, çözeltideki sodyum klorür ayrışır ve iyonlar oluşturur ve bu iyonlar sırasıyla aşağıdaki moleküller tarafından çözülür. Su.
Suyun pozitif kutbu (H+) tuzun anyonu ile etkileşime girer (Cl-) ve suyun negatif kutbu (O2-) katyon ile etkileşir (Na+).
Çözeltideki iyonik türler bir elektrik akımı iletme yeteneğine sahip olduğundan, bu bir elektrolitik çözelti türüdür.
su ve şeker
- Çözünen: Şeker - Sükroz (C12H22Ö11)
- Çözücü: Su

Şeker kovalent bir bileşiktir ve suda çözündüğünde moleküller dağılırlar ama kimliklerini değiştirmezler.
Bu sulu çözelti, çözelti içinde dağılan çözünen nötr olduğundan ve bu nedenle su ile reaksiyona girmediğinden elektrolitik olmayan olarak sınıflandırılır.
Sirke
- Çözünen: Asetik asit (CH3COOH)
- Çözücü: Su

Sirke en az %4 asetik asit içeren bir çözeltidir. karboksilik asit polar olduğu için su ile hidrojen bağları yoluyla da polar etkileşime girer.
Çözünürlük için önemli bir kural, benzerinin benzerini çözmesidir. Polar bileşikler polar çözücülerde çözülürken, polar olmayan maddeler polar olmayan çözücülerde çözünür.
Diğer çözümler
Sıvı çözeltilere ek olarak gaz ve katı çözeltiler de vardır.
Soluduğumuz hava, gazları daha fazla miktarda nitrojen (%78) ve oksijen (%21) olan gazlı bir çözelti örneğidir.
saat metal alaşımları sağlam çözümlerdir. Örneğin pirinç (çinko ve bakır), müzik aletleri yapımında kullanılan bir karışımdır.
Daha fazla bilgi edinmek ister misiniz? Yani bu diğer metinleri okuyun:
- Kimyasal Çözümler
- moleküller arası kuvvetler
- Homojen ve heterojen karışımlar
Çözünürlük Katsayısı nedir?
Çözünürlük katsayısı, doymuş bir çözelti oluşturmak için belirli bir sıcaklıkta çözücüye eklenen çözünen maddenin sınırıdır.
Ö çözünürlük katsayısı şartlara göre değişir ve sıcaklık ve söz konusu çözünen maddedeki değişikliklere göre artabilir veya azalabilir.
Çözücünün çözünmeyi gerçekleştirebileceği bir sınır vardır.
Misal: Bir bardak suya şeker koyarsanız, ilk anda şekerin suda kaybolduğunu fark edeceksiniz.
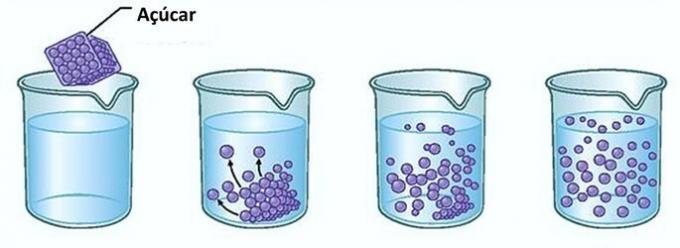
Ancak şeker eklemeye devam ederseniz, bir noktada bardağın dibinde birikmeye başladığını göreceksiniz.
Bunun nedeni, çözücü olan suyun limitine ulaşmış olmasıdır. çözünürlük ve maksimum konsantrasyon miktarı. Kabın dibinde kalan ve çözünmeyen maddeye denir arka plan gövdesi.
Bardağın dibindeki fazla şeker çözülmeyecek ve çözeltinin konsantrasyonunu etkilemeyecektir. Ayrıca bardağın dibinde biriken şeker suyu daha tatlı yapmaz.
Çözümlerin sınıflandırılması
Çözeltiler, çözünen çözünen miktarına göre sınıflandırılabilir. Böylece, üç tip olabilirler: doymuş, doymamış ve aşırı doygun.
- doymuş Çözelti: Çözelti, çözünürlük katsayısı sınırına ulaştı, yani belirli bir sıcaklıkta çözücüde çözünen maksimum miktarda çözünen var.
- doymamış çözelti: Çözünen madde miktarı henüz çözünürlük katsayısına ulaşmamıştır. Bu, daha fazla çözünen eklenebileceği anlamına gelir.
- aşırı doymuş çözelti: Normal koşullara göre daha fazla çözünen madde vardır. Bu durumda, bir çökelti sunarlar.
Çözümler hakkında daha fazla bilgi edinmek için aşağıdaki metinleri okuyun.:
- çözeltilerin seyreltilmesi
- molalite
- molarite
- Titrasyon
Çözümlerin konsantrasyonu
Çözünen ve çözücüden bir çözeltinin konsantrasyonunu hesaplamak mümkündür.
Ortak konsantrasyon, belirli bir çözelti hacminde çözünen maddenin kütlesinin oranı olarak tanımlanır.
Konsantrasyon hesaplaması aşağıdaki formül kullanılarak yapılır:
Olmak,
Ç: Konsantrasyon (g/L);
m: çözünen kütlesi (g);
V: çözelti hacmi (L).
Misal:
(Faap) 400 mL çözelti içinde 30 g tuz içeren sulu bir sodyum nitrat çözeltisinin g/L cinsinden konsantrasyonunu hesaplayın:
çözüm:
Çözünen ve çözücü miktarları ile ilgili bilgileri dikkate alın. 400 mL sulu çözeltide (çözücü) 30 g tuz (çözünen) vardır.
Ancak, hacim mL cinsindendir ve onu L'ye dönüştürmemiz gerekir:
Şimdi, konsantrasyonu bilmek için formülü uygulamanız yeterlidir:
Bu sonuçla 30 g tuzu 400 mL su ile karıştırdığımızda 75 g/L konsantrasyonda bir çözelti elde edeceğimiz sonucuna ulaştık.
Ortak konsantrasyonun nasıl hesaplanacağı hakkında daha fazla bilgi için bu metinler yardımcı olacaktır.:
- Çözelti Konsantrasyonu
- Ortak Konsantrasyon Üzerine Alıştırmalar