Aynı elementin asitleri olabilir ve bu element aynı oksidasyon numarasına (NOX) sahiptir, ancak fark hidrasyon derecelerindedir.
Örneğin, aşağıda fosfor (P) elementinin oluşturduğu üç asidimiz var:
H3TOZ4 H4P2Ö7 HPO3
Her üç asitte de fosforun oksidasyon sayısının +5 olduğuna dikkat edin; fark hidrasyon derecesindedir.
Buna dayanarak, bu asitler isimlendirmede öneklerle ayırt edilir. orto, piro ve meta.
En hidratlı asit orto olarak adlandırılır.. Verilen örnekte, ilk (H3TOZ4) denir asit ortofosforik, çünkü üçü arasında en sulu olanıdır. Orto öneki harcanabilir, bu nedenle çoğu zaman bu asit sadece çağrılacak fosforik asit.
Pyro ve meta önekleri, referans noktası olarak orto asitle birlikte kullanılır:
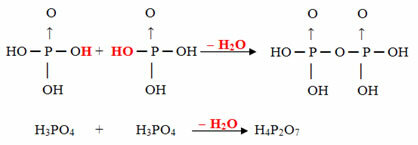
- Pyrus: 2 molekül orto eksi 1 molekül H2Ö
Örnek: H4P2Ö7 denir asit pirofosforik çünkü iki molekül ortofosforik asit (H3TOZ4) eksi bir su molekülü.
2. H3TOZ4 =H6P2Ö8
H6P2Ö8 -H2O = H4P2Ö7
Bu süreç bir moleküller arası dehidrasyon:
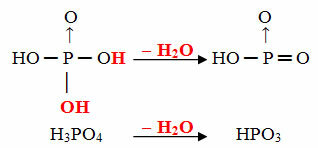
- Hedef: 1 molekül orto eksi 1 molekül H2Ö
Örnek: HPO3 denir asit hedeffosforik çünkü bir ortofosforik asit molekülüne eşittir (H3TOZ4) eksi bir su molekülü.
H3TOZ4 -H2O = HPO3
Bu süreç bir molekül içi dehidrasyon:
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm
