1960 yılında Linus Pauling tarafından oluşturulan orbital modeline göre, Moleküller, olayda yer alan elementlerin tamamlanmamış orbitallerinin kaynaşması veya iç içe geçmesiyle oluşur. Bağlantı. Böylece, elementin eksik bir yörüngesi varsa (yalnızca bir elektronlu), yalnızca bir kovalent bağ yapabileceği sonucuna varılır. İki eksik yörüngesi varsa, en fazla iki bağlantı yapabilir vb.
Ancak atom numarası 6 (Z = 6) olan karbon atomunun atom orbitallerine bakın:
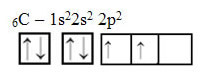
İki tamamlanmamış yörüngeye sahip olduğuna dikkat edin, bu nedenle en fazla yalnızca iki bağlama gerçekleştirmelidir. Ancak, onun başına gelen bu değil. Birçoğunun bildiği gibi, karbon dört bağ yapar (dört değerlidir), bu nedenle bu orbital modeli karbon durumunu açıklamaz.
Bu açmazı sona erdirmek için, bu konuyu daha iyi açıklayan yeni bir teori oluşturuldu: Hibridizasyon Teorisi.

Bu, hibridizasyonun saf orbitallerin bir "karışımı" olduğu anlamına gelir.
Karbon için üç tür hibridizasyon vardır, bunlar: sp3, sp2 ve sp.
Hibridizasyonun nasıl gerçekleştiğini anlamak için ilk karbon hibridizasyonu tipine, sp tipine bakalım.3:
Bu tür hibridizasyon metan molekülünde (CH4). Merkezi element olan karbon ile dört hidrojen arasında dört özdeş kovalent bağ olduğuna dikkat edin. Öyleyse, tamamlanmamış hidrojen yörüngesinin ne olduğuna bakın:
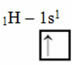
Her hidrojenin eksik bir s-tipi yörüngesi olduğundan, bir elektron daha almak gerekir, yani her biri karbonla sadece bir kovalent bağ yapar. Bu yüzden karbonun dört eksik yörüngeye sahip olması gerekir. Bu nasıl olur? Hibridizasyon yoluyla.
2s orbitalinden bir elektron enerji emdiğinde, boş 2p orbitaline geçer. Böylece, elektronun 2s'den 2p alt seviyesine bu sıçramasının elektronun bir "terfisi" olduğunu söylüyoruz. Bu şekilde, karbon, kovalent bağları gerçekleştirmek için mevcut dört hibritleştirilmiş orbital ile uyarılmış veya aktive edilmiş durumunda kalır:
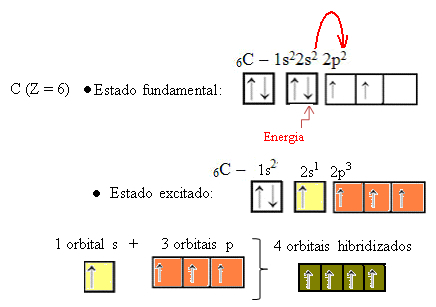
Oluşan hibrit orbitallerin birbirine eşdeğer olduğuna, ancak orijinal saf orbitallerden farklı olduğuna dikkat edin.
Bu şekilde, dört hidrojen atomunun her birinin s orbitali arasındaki bağ, bu dört hibritleştirilmiş karbon orbitaliyle oluşur:
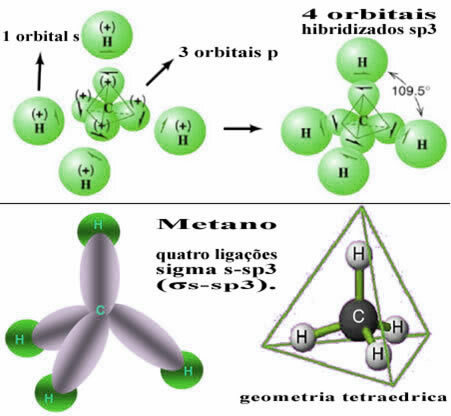
Yukarıda görüldüğü gibi, metan molekülü, her bir tepe noktasında dört elektron bulutu ve 109°28' bitişik açılarla düzenli bir tetrahedron yapısına sahiptir. Bağ, her hidrojenin bir s orbitali ile hibritleştirilmiş bir sp orbitali arasında yapıldığından3 her bağlantı için, o zaman biz onların dört sigma s-sp bağlantısı3 (σs-sp3).
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm

