Kimyasal elementlerin organize edilme yollarından biri, periyodik tablonun dikey dizilerine karşılık gelen ailelerdir.
at 18 sütun Tablodaki elementleri kimyasal özelliklerdeki benzerliklere göre gruplandırın.
Kimyasal elementleri ailelere ayırmak, bulunan çeşitli bilgileri yapılandırmanın ve bunları basit bir şekilde sunmanın pratik bir yoluydu.
Bir kimyasal elementin yerini kolaylaştırmak için, aileler 1'den 18'e kadar sayılarla şu şekilde belirlendi:
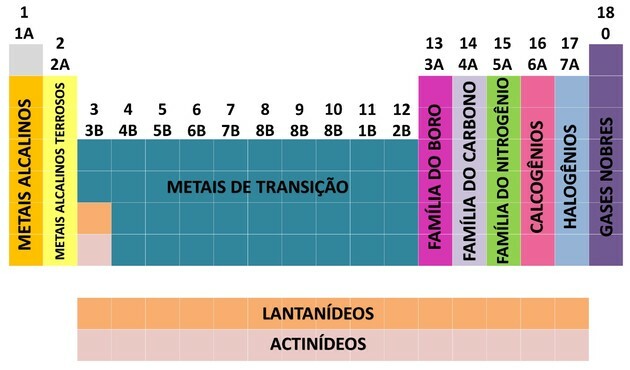
Birçok bilim insanının katkısı ve verileri düzenlemeye yönelik çeşitli girişimler sayesinde, periyodik tablo gelişti ve elementleri düzenlemek için bir düzen oluşturdu.
Ailelerin isimlendirilmesi
- Tablodaki aileler harf ve rakamlarla tanımlanarak A (temsilci) ve B (geçiş) olarak ayrılmıştır.
- Sen Temsili unsurlar 0, 1A, 2A, 3A, 4A, 5A, 6A ve 7A aileleri karşılık gelir.
- Sen geçiş elemanları 1B, 2B, 3B, 4B, 5B, 6B, 7B ve 8B ailelerine karşılık gelir.
- International Union of Pure and Applied Chemistry (IUPAC) tarafından belirlenerek, aileler 1'den 18'e kadar olan gruplar.
Periyodik Tablo ve Elektronik Dağıtım
Aynı ailenin elemanları arasındaki benzerlikler, belirli bir grubun üyeleri için temel durumdaki atomun değerlik elektronlarının sayısının aynı olması nedeniyle oluşur.
Örneğin:
| Grup 1 | elektronik dağıtım |
|---|---|
| 3oku | 2-1 |
| 11at | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55C'ler | 2-8-18-18-8-1 |
| 87Cum | 2-8-18-32-18-8-1 |
Grup 1 atomlarının elektronları birden fazla enerji seviyesine dağılmıştır, ancak hepsinin bir değerlik elektronu vardır.
Bununla birlikte, yaptığımızı gözlemliyoruz. elektronik dağıtım atomun temel durumunda, periyodik tablodaki konumunu buluruz.
Temsili unsurlar
Temsili elementler, geçiş elementlerinden nispeten daha az karmaşık kimyasal davranış sergiler ve etrafımızdaki maddelerin çoğunu oluşturur.
Temsili eleman ailelerinden bazılarına aşağıda gösterildiği gibi özel isimler verilmiştir:
Grup |
Aile | özel isim | isim kökeni | Elementler | elektronik konfigürasyon |
|---|---|---|---|---|---|
| 1 | 1 A | alkali metaller | latinceden alkali, "bitkilerin grisi" anlamına gelir. | Li, Na, K, Rb, Cs ve Fr | bize1 |
| 2 | 2A | alkali toprak metalleri | "Dünyasal" terimi, "yeryüzünde var olan" anlamına gelir. | Be, Mg, Ca, Sr, Ba ve Ra | bize2 |
| 13 | 3 A | bor ailesi | Ailenin ilk öğesinin adı. | B, Al, Ga, In, Tl ve Nh. | bize2np1 |
| 14 | 4A | karbon ailesi | Ailenin ilk öğesinin adı. | C, Si, Ge, Sn, Pb ve Fl. | bize2np2 |
| 15 | 5A | azot ailesi | Ailenin ilk öğesinin adı. | N, P, As, Sb, Bi ve Mc. | bize2np3 |
| 16 | 6A | Kalkojenler | yunancadan halk, bakır cevherlerinde bulunan elementler oldukları için. | O, S, Se, Te, Po ve Lv. | bize2np4 |
| 17 | 7A | halojenler | Tuz oluşturucular anlamına gelen Yunanca ifade. | F, Cl, Br, I, At ve Ts. | bize2np5 |
| 18 | 0 | Soy gazlar | Diğer maddelerle reaksiyona girmeyeceği düşünülmüştür. | O, Ne, Ar, Kr, Xe, Re ve Og. | 1s2 (O) veya biz2np6 |
Tablodan şunu görebiliriz:
- Yukarıda sunulan elementler, bir s veya p alt seviyesinde en enerjik elektrona sahip oldukları için temsili olarak sınıflandırılır.
- Elektronlar enerji seviyelerine dağılmıştır ve n, atomun temel durumundaki en dış seviyesini temsil eder.
- IUPAC'ın tavsiyesine göre temsili unsurlar 1,2,13,14,15,16,17 ve 18 gruplarına veya ailelerine aittir.
Ö hidrojen diğer unsurlardan ayrı olarak sınıflandırılır. 1s elektronik konfigürasyonda bile1, tekil bir davranış sergilediği için 1. grubun parçası değildir.
geçiş elemanları
Geçiş elemanları, 3 ila 12 arasındaki gruplara karşılık gelir. Grup 1 ve 2 arasında ara özelliklere ve temsili metalik olmayan elementlere sahip oldukları için bu ismi alırlar.
Sen geçiş metalleri IUPAC tarafından şu şekilde tanımlanır:
Bir geçiş elemanının tamamlanmamış bir d alt düzeyi vardır veya tamamlanmamış bir d alt düzeyi ile katyonlar oluşturabilir.
Temel durum atomunun en enerjik elektronu tamamlanmamış bir d alt seviyesinde olduğunda, bir dış geçiş olarak karakterize edilir.
Lantanitler ve aktinitler, en az bir eksik f alt seviyesine sahip oldukları için dahili geçiş elementleridir.
Elementler, d veya f orbitallerini dolduran elektronlara sahip olduklarında, benzer özellikler sergilerler ve d veya f orbital elementleri olarak sınıflandırılabilirler. dış veya iç geçiş.
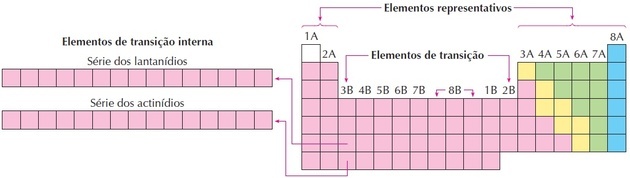
Resimde gördüğümüz gibi 8B ailesi 3 sütuna karşılık gelir, bunlar benzer özelliklere sahip oldukları için bu şekilde gruplandırılmış 8, 9 ve 10 gruplarıdır.
Ailelerin temel özellikleri
Aşağıdaki tablo, periyodik tablodaki grupların ana özelliklerini göstermektedir:
| Grup | Özellikleri | bileşik maddeler daha yaygın |
olaylar |
|---|---|---|---|
| 1 | Ortam koşullarında sağlam ve parlaktır. Çok reaktif, yumuşak ve elektriği iyi iletir. | Tuzlar, hidroksitler ve oksitler |
Halojenlerle reaksiyona girer ve tuzlar oluşturur. |
| 2 | Grup 1'den daha az reaktif ve daha sert. İyi iletkenliğe sahip gümüş katılar. | Tuzlar, hidroksitler ve oksitler |
Tuzlar ve oksitler oluşturur. |
| 3 ila 12 | Kompleksler oluştururlar. Bir sıvı olan cıva hariç, sert ve kırılgan metalik katılardır. | Tuzlar, oksitler ve kompleksler. Örn: AgNO3, TiO ve [Cr(OH)3(H2Ö)3] |
minerallerde oksitler şeklinde. |
| 13 | Ortam şartlarında katılar, bor hariç gümüş. | oksitler Örn: B2Ö3 |
minerallerde oksitler şeklinde. |
| 14 | Ortam koşullarında katı. | C ve Si atomları kendilerini zincirler halinde düzenleyebilir ve çok çeşitli maddeler üretebilir. | Canlı organizmalarda ve silikatlar veya oksitler şeklinde. |
| 15 | Ortam koşullarında gaz halinde olan nitrojen hariç katılar. | Oksitler ve asitler Örn: HAYIR2 ve H3TOZ4 |
Atmosfer, canlı organizmalar ve mineraller. |
| 16 | Ortam koşullarında gaz halinde olan oksijen hariç katılar. | Sülfürler ve oksitler Örn: ZnS ve SiO2 |
Atmosfer, canlı organizmalar ve mineraller. |
| 17 | İki atomlu moleküller oluştururlar ve çok reaktiftirler. Elektrik ve ısıyı kötü iletirler. Canlılara ve çevreye karşı saldırgandırlar. | Asitler ve Tuzlar. Örn: HCl ve KBr |
maddelerde bulunur organik ve mineral. |
| 18 | Çok kararlıdırlar ve gaz halinde bulunurlar. | Zor bileşik maddeler oluştururlar. | Atmosferdeki gazlar. |
Kimyasal ve fiziksel özellikler bir aileyi diğerinden ayırır. Gördüğümüz gibi, kimyasal özellikler ile ilgilidir. elektronlar değerlikve onlar aracılığıyla, bir atom diğeriyle etkileşime girer, kimyasal davranıştan sorumlu olur ve Kimyasal bağlar oluşturulan.
Aynı gruptaki elementlerin fiziksel özellikleri atom numarasına ve kütleye göre değişebilir.
Egzersizler
Artık Periyodik Tablo aileleri hakkında biraz daha bilgi sahibi olduğunuza göre, bilginizi test edin ve neler öğrendiğinizi görün.
1) Periyodik Tablodan aşağıdaki alıntıyı inceleyin.
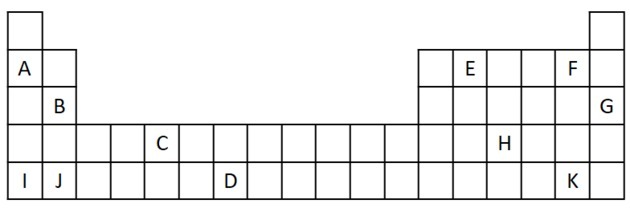
a) İki değerlik elektronu olan iki elementi adlandırın.
b) Su ile şiddetli reaksiyona girerek metal hidroksit üreten bir elementi belirtin.
c) Reaktif olmayan bir elemanı belirtin.
d) Alkali metallerle birleşerek tuz oluşturan iki elementi belirtiniz.
Cevap:
a) B ve J
İki değerlik elektronu, ns elektron konfigürasyonuna sahip grup 2'ye karşılık gelir.2 ve alıştırmada B ve J ile temsil edilmektedir.
b) A, B, I veya J.
A ve I, aile 1'in öğelerini temsil eder; B ve J 2. ailedendir. Özellikler tablosunda gördüğümüz gibi grup 1 ve 2 elementleri çok reaktiftir ve verilen örneklerde olduğu gibi hidroksit oluşturabilir: KOH ve Mg (OH)2.
c) G
Soy gazlar çok kararlıdır ve bu nedenle çok reaktif değildir. G harfi bu ailenin bir elemanı olarak tabloya eklenmiştir.
d) F ve K
Halojenler, tuzları oluşturmak için alkali metallerle reaksiyona girer. Bunun en yaygın örneği sofra tuzu, NaCl'dir.
2) Aşağıdaki şekil, soldan sağa, lityum, sodyum ve potasyum olmak üzere üç kimyasal elementi göstermektedir.

Aşağıdaki ifadelerin her birini doğru şekilde tamamlayan seçeneği işaretleyiniz.
1.1) "Lityum, sodyum ve potasyum diyebiliriz...
(A) … aynı döneme aittir.”
(B) …aynı atom numarasına sahiptir.”
(C) … aynı gruba aittir.”
(D) …aynı kütle numarasına sahip.”
1.2) "Lityum, sodyum ve potasyum elementleri...
(A) …çok benzer kimyasal özelliklere sahiptir.”
(B) …çok farklı kimyasal özelliklere sahiptir.”
(C) … metal değildir.”
(D) … asidik çözeltiler oluşturmak için suyla reaksiyona girer.”
Yanıtlar:
1.1) (C) aynı gruba aittir.
1.2) (A) çok benzer kimyasal özelliklere sahiptir.
Bu bilgiyi periyodik tabloya bakarak veya lityum, sodyum ve potasyum elementlerinin elektronik dağılımını yaparak elde edebiliriz. Üçünün değerlik kabuğunda bir elektronu olduğunu ve aynı grubun parçası olduklarından kimyasal özelliklerinin çok benzer olduğunu göreceğiz.
3) Bazı kimyasal elementlerin atom numaralarının ve elektronik dağılımlarının gösterildiği aşağıdaki tabloyu göz önünde bulundurun.
| eleman | kimyasal sembol | atomik numara | elektronik dağıtım |
|---|---|---|---|
| Lityum | oku | 3 | 2,1 |
| Berilyum | olmak | 4 | 2,2 |
| flor | F | 9 | 2,7 |
| neon | ha | 10 | 2,8 |
| klor | Cl | 17 | 2,8,7 |
| argon | Hava | 18 | 2,8,8 |
| Potasyum | K | 19 | 2,8,8,1 |
| Kalsiyum | Buraya | 20 | 2,8,8,2 |
Her öğenin grubunu belirtin.
Cevap:
Lityum ve potasyum: grup 1. (Değerlik kabuğunda bir elektronları vardır).
Berilyum ve kalsiyum: grup 2. (Değerlik kabuğunda iki elektronları vardır).
Flor ve klor: grup 17. (Değerlik kabuğunda yedi elektronları vardır).
Neon ve argon: grup 18. (Değerlik kabuğunda sekiz elektronları vardır).
Giriş sınavı sorularını şurada yorumlanmış bir çözümle kontrol edin: Periyodik Tabloda Egzersizler ve konuyla ilgili yayınlanmamış sorular Periyodik Tabloyu Düzenleme Alıştırmaları.


