değerlik katmanı bir atomun en dış tabakası (veya seviyesi) (çekirdekten en uzak), yani çekirdekten en uzak olanıdır. Bu nedenle, sözde en dıştaki elektronlara veya değerlik elektronlarına sahiptir.
Bir atomun sahip olabileceği düzey sayısı, aşağıdaki alt düzeylere (sarı renkte) sahip olan 1 ile 7 arasında değişir:
seviye K (1. katman): alt seviye s
seviye L (2. katman): alt seviyeler s ve P
seviye M (3. katman): alt seviyeler s, P ve d
seviye N (4. katman): alt seviyeler s, P, d ve f
seviye O (5. seviye): alt seviyeler s, P, d ve f
P seviyesi (6. seviye): alt seviyeler s, P ve d
seviye Q (1. katman): alt seviyeler s ve P
Alt seviyelerin her biri farklı sayıda elektron tutar. Bak:
alt seviye s maksimum 2 elektron tutar;
alt seviye p maksimum 6 elektron tutar;
alt seviye d maksimum 10 elektron tutar;
alt seviye f maksimum 14 elektron tutar.
Bu nedenle, belirli bir atomun değerlik kabuğu M ise, alabileceği maksimum elektron sayısı içinde mevcut olmak 18 (s alt seviyesinden 2 elektron + p alt seviyesinden 6 elektron + alt seviyeden 10 elektron) alt düzey d).
Bir atomun değerlik kabuğunu ve kaç elektrona sahip olduğunu belirlemek için iki yol vardır:
→ Elektronik dağıtımdan değerlik kabuğunun ve elektron sayısının belirlenmesi
Elektronik dağıtımlar her zaman Linus Pauling diyagramı, aşağıda temsil edilmektedir:

Linus Pauling diyagramının gösterimi
Sıradan atomik numara (bir atomdaki elektron sayısını gösterir), elektronik dağılımı yaparız. Örneğin, atom numarası 50 olan bir atom:

Atom numarası 50'ye eşit olan atomun elektronik dağılımı
Yukarıdaki dağılımı analiz ederek, çekirdekten en uzak seviyenin, 4 elektronun (ikisi s alt seviyesinde ve 2 tanesi p alt seviyesinde) bulunduğu 5. (N seviyesi) olduğunu görüyoruz.
→ Periyodik Tablodan değerlik kabuğunun ve elektron sayısının belirlenmesi
Tablo, bir atomun seviyelerinin sayısını ve grupları veya aileleri (dikey sütunlar) gösteren periyotlar (yatay sütunlar) halinde düzenlenmiştir. Periyodu belirlemek için kullanılır. değerlik katmanı, ve aileler elektron sayısını belirlemek için kullanılır.
a) Kimyasal elementin periyodunu bilmek
Periyodik Tablo, Linus Pauling diyagramında bulunan seviyelerin sayısı ile ilgili olan toplam yedi periyot sunar. Yani, hangi dönemi bilirsek, kimyasal element tablonun içindedir, otomatik olarak atomlarınızın kaç seviye olduğunu biliyoruz, değerlik tabakası çekirdeğe en uzak seviyedir.
1. Örnek: Kimyasal element Potasyum
Potasyum, Periyodik Tablonun dördüncü periyodunda yer alır, bu nedenle atomunun dört tane vardır. seviyeler, dördüncü seviye, dağılımı ile teyit edilen değerlik katmanıdır. elektronik.
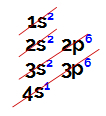
Potasyum elementinin elektronik dağılımı
2. Örnek: Kimyasal element flor
Flor, Periyodik Tablonun ikinci periyodunda yer alır, bu nedenle atomunun iki seviyeler, ikinci seviye, dağılımı ile teyit edilen değerlik katmanıdır. elektronik.

Flor elementinin elektronik dağılımı
3. Örnek: İndiyum kimyasal elementi
Şimdi durma... Reklamdan sonra devamı var ;)
Hintli Periyodik Tablonun beşinci periyodunda yer alır, bu nedenle atomunun beşi vardır. seviyeler, beşinci seviye, dağılımı ile teyit edilen değerlik katmanıdır. elektronik.

İndiyum elementinin elektronik dağılımı
b) Kimyasal elementin ailesini veya grubunu bilmek
Elementin bulunduğu aileyi veya grubu bildiğimizde, o elementin değerlik kabuğunda bulunan elektronların sayısını da biliyoruz.
A ailesinin unsurları
A ailelerinin elemanları, Periyodik Tablonun 1, 2, 13 ila 18. sütunlarında yer alır. Bu sütunların her biri, bu elementlerin değerlik kabuğundaki elektron sayısını tam olarak gösteren bir sayı (1 ila 8, Romen rakamı) alır:
Sütun 1 - IA ailesi = hepsinin değerlik kabuğunda 1 elektronu vardır;
Sütun 2 - IIA ailesi = hepsinin değerlik kabuğunda 2 elektronu vardır;
Sütun 3 - IIIA ailesi = hepsinin değerlik kabuğunda 3 elektronu vardır;
Sütun 4 - IVA ailesi = hepsinin değerlik kabuğunda 4 elektronu vardır;
Sütun 5 - VA ailesi = hepsinin değerlik kabuğunda 5 elektronu vardır;
Sütun 6 - VIA ailesi = hepsinin değerlik kabuğunda 6 elektronu vardır;
Sütun 7 - VIIA ailesi = hepsinin değerlik kabuğunda 7 elektronu vardır;
Sütun 8 - VIIIA ailesi = hepsinin değerlik kabuğunda 8 elektronu vardır.
A ailesinin bazı elemanlarının değerlik elektronlarının sayısının belirlenmesine ilişkin bazı örneklere bakın:
Örnek 1: kimyasal element baryum
Baryum, IIA ailesinde bulunur, bu nedenle değerlik kabuğunda elektronik dağılımı ile onaylanan iki elektronu vardır:

Baryum elementinin elektronik dağıtımı
Örnek 2: antimon kimyasal element
Antimon, VA ailesinde bulunur, bu nedenle değerlik kabuğunda elektronik dağılımı ile onaylanan beş elektronu vardır:

Antimon elementinin elektronik dağılımı
Örnek 3: Ksenon kimyasal element
Xenon, VIIIA ailesinde bulunur, bu nedenle elektronik dağılımı ile onaylanan değerlik kabuğunda sekiz elektrona sahiptir.

Xenon elemanının elektronik dağıtımı
NOT: Önerilen kurala uymayan A ailesine ait tek kimyasal element Helyumdur. VIIIA ailesine aittir, ancak değerlik kabuğunda sadece iki elektronu vardır. Bunun nedeni atom numarasının 2 olmasıdır, bu nedenle ailedeki diğer elementler gibi değerlik kabuğunda 8 elektrona sahip olması imkansızdır.
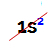
Bir helyum atomunun elektronik dağılımı
Aile B öğeleri
B ailelerinin elementleri Periyodik Tablonun 3 ila 12. sütunlarında yer alır. A ailelerinin yanı sıra, Romen rakamlarıyla temsil edilen sekiz B ailesi de vardır. A ailelerinin aksine, B ailesinin sayısı değerlik kabuğundaki elektronların sayısını belirlemez.
B ailesindeki bir elementin değerlik kabuğundaki elektron sayısı, atom numarası ve tablodaki konumu ne olursa olsun her zaman 2'ye eşittir. Kaliforniyumun elektronik dağılımları (98Cf) ve hassius (108hs) bunu kanıtlayın:
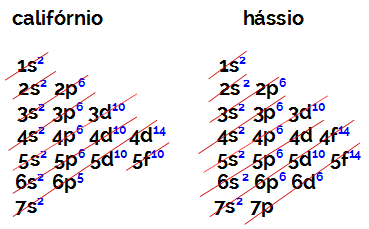
Kaliforniyumun elektronik dağılımı, en enerjik alt seviye olan 5f'ye sahiptir.10, ve hassius'un o'su 6d'dir6. Her iki durumda da çekirdekten en uzak alt düzey yedinci düzeydir ve her ikisinin de dağıtılmış iki elektronu vardır.
Benden Diogo Lopes Dias