Organik bileşikler molekülerdir, yani atomları birbirleriyle kovalent bağlar taşır. Karbonlar arasındaki tekli, ikili veya üçlü olabilen bağları incelediğimizde, bunların Polar olmayan bağlar, atomlar arasında elektronegatiflik farkı olmadığından, aynı atomlara ait oldukları için öğe.
Ayrıca, hidrojen ve karbon arasında çok küçük bir elektronegatiflik farkı olduğundan, aralarındaki bağlar da polar değildir.
Polar olmayan bağlantılar:
Bununla, şu sonuca varabiliriz: hidrokarbonlar (sadece karbon ve hidrojen atomlarına sahip organik bileşikler) polar olmayan moleküllerdir. Bu bileşiklerde, moleküller arası etkileşim, var olan en zayıf olan indüklenmiş dipol tipindedir.
Zayıf olduklarından, bu etkileşimlerin kırılması kolaydır. Buna bağlı, hidrokarbonların kaynama ve erime sıcaklıkları diğer fonksiyonlara göre daha düşüktür.

hidrokarbonların karşılaştırılması, molar kütle arttıkça kaynama noktaları da artacaktır.
Örneğin etan ve bütanın ikisi de alkandır. Deneysel olarak belirlenen her birinin kaynama noktalarına bakın:
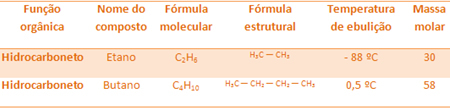
Bütanın kaynama sıcaklığının, mol kütlesi de daha yüksek olduğu için etandan çok daha yüksek olduğuna dikkat edin.
Şimdi aynı molar kütleye sahip (izomerlerdir) ancak farklı tipte karbon zincirlerine sahip hidrokarbonları karşılaştırdığımızda, şunu fark ederiz: dal sayısı arttıkça kaynama sıcaklığı düşer, çünkü molekülün yapısı daha kompakt hale gelir, yani yüzeyi küçülür.
Şimdi durma... Reklamdan sonra devamı var ;)
Aşağıdaki tüm alkanlar aynı moleküler formüle sahiptir, C5H12, ancak kaynama sıcaklıkları farklıdır:
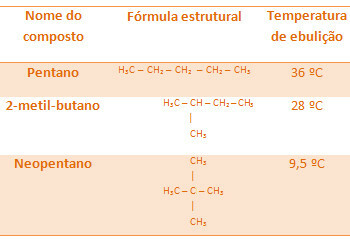
Neopentanın kaynama sıcaklığının daha fazla dalı olduğu için en düşük olduğunu unutmayın.
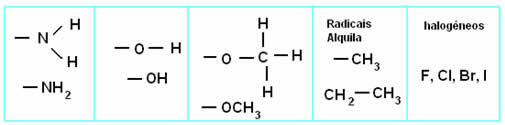
Diğer organik fonksiyonların, bir veya daha fazla hidrojenin diğer elementlerin atomları veya atom grupları ile değiştirilmesi yoluyla hidrokarbonlardan türetildiğini düşünebiliriz. Genel olarak, diğer organik fonksiyonlar, karbondan daha elektronegatif elementler olan oksijen veya nitrojene sahiptir. Karbonla paylaşılan elektron çiftini daha güçlü bir şekilde çekerler ve bu nedenle molekülü polar hale getirirler:
Kutup bağlantıları:
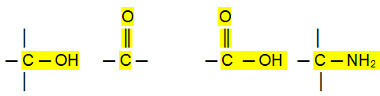
Aldehitler, ketonlar ve organik halojenürler daha yüksek kaynama noktalarına sahiptir. hidrokarbonlar, çünkü moleküller arası etkileşimleri, hidrokarbonlardan daha güçlü olan kalıcı dipoldür. indüklenmiş dipol.
Alkoller, karboksilik asitler ve aminler ise, moleküller arası etkileşimin en yoğun türü olan hidrojen bağlarını gerçekleştirdiklerinden daha da yüksek kaynama sıcaklıklarına sahiptir.
Tüm bu işlevlere sahip bileşikler için, hidrokarbonlar için gördüğümüzle aynı şey geçerlidir:

Jennifer Foğaça tarafından
Kimya mezunu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
FOGAÇA, Jennifer Rocha Vargas. "Organik bileşiklerin polaritesi ve kaynama sıcaklığı"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm. 28 Haziran 2021'de erişildi.