“Kimyasal bağ”, ilk kez 1920 yılında Gilbert Newton Lewis tarafından bunun nedenini açıklamak için bir makalede kullanılan bir terimdi. atomların maddeler oluşturmak için birbirine yapıştığı ve ayrıca neden binlerce yaşında.
Şimdiye kadar bilinen ve Periyodik Tabloda listelenen çoğu kimyasal elementin atomları, doğada izole halde bulunmazlar. Günlük hayatımızda bulunan malzemelerin çoğu basit (atomlardan oluşan) olabilen maddelerdir. sadece bir kimyasal element türü) veya kompozitler (iki veya daha fazla kimyasal elementin atomlarına sahip olanlar) çok farklı).
Bunun nedeni, atomların aynı element veya farklı elementler olabilen diğer atomlarla kimyasal bağlar kurma kabiliyetine sahip olmasıdır. Bu bağlar o kadar güçlüdür ki, herhangi bir dış etki olmaksızın, çoğu durumda atomlar oldukları gibi bağlı kalır.
Zihin Haritası: Kimyasal Bağlar

*Zihin haritasını PDF olarak indirmek için, Buraya Tıkla!
Örneğin, doğada serbest oksijen atomu bulmak yaygın değildir; bununla birlikte, diğer atomlara bağlı göründüğü birkaç madde buluyoruz. Basit bir maddenin bir örneği, her bir molekülün iki bağlı oksijen atomu tarafından oluşturulduğu oksijen gazıdır (O
2); Her molekülün bir oksijen atomuna (H) bağlı iki hidrojen atomuna sahip olduğu su, bileşik bir maddenin bir örneğidir.2Ö).Doğada kararlı bir şekilde izole edilmiş bulunan tek elementler, soy gazlar, yani Periyodik Tablonun 18 ailesinin elemanları (He, Ne, Ar, Kr, Xe ve Rn). Tüm bu elementlerin ortak özelliği, helyum (He) hariç, son elektron kabuğunda (değerlik katmanı) sekiz elektrona sahip olmalarıdır. sadece bir elektron kabuğuna (K katmanı) sahip olan ve bu nedenle iki elektronu tutan ki bu, bu durumdaki mümkün olan maksimum elektron sayısıdır. katman.
Böylece, Gilbert N. Lewis ve ayrıca bilim adamı Water Kossel şu sonuca varmışlardır: diğer elementlerin atomları sekiz elektrona (ya da sadece K kabuğuna sahipseniz iki elektrona) sahip olacak şekilde bağlanır ve böylece kararlı hale gelir. Yaratıldı, o zaman, elektronik değerlik teorisi, açıklanan fikre dayanarak bir elementin atomunun kaç kimyasal bağ yaptığını gösterir.
Şimdi durma... Reklamdan sonra devamı var ;)
Bu nedenle, atomlar, bir sonraki soy gazın konfigürasyonuna ulaşana kadar değerlik kabuğu elektronlarını kaybetmeye, kazanmaya veya paylaşmaya çalışarak kimyasal bağlar kurar.Bu teori aynı zamanda çağrıldı sekizli kuralı.
Örneğin oksijen iki değerlidir çünkü değerlik kabuğunda altı elektron bulunur. Bu nedenle, soy gaz neonunun (Ne) bir konfigürasyonuna sahip olmak için iki elektron daha alması gerekir, yani bu durumda L kabuğu olan değerlik kabuğunda sekiz elektron bulunur. Bahsedilen oksijen gazı ve su durumunda, aşağıdakilere sahibiz:
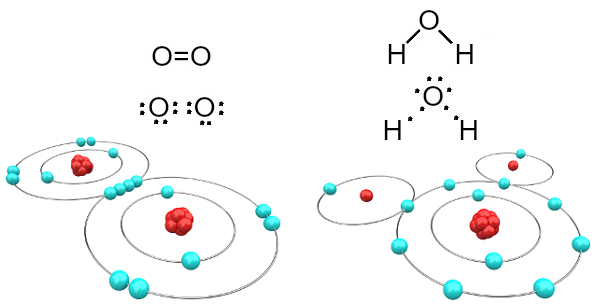
Kovalent bağların oluşturduğu oksijen ve su molekülleri
İlk durumda (oksijen gazı - O2), her oksijen atomu, her ikisi de değerlik kabuğunda sekiz elektrona sahip olan iki elektronu paylaşır. Bunun anlamı, bir çift bağ (iki atom arasında aynı anda iki bağ).
Su durumunda, iki hidrojen atomunun her biri, merkezi oksijen atomuyla bir elektronu paylaşır ve hepsi kararlıdır (oksijen değerlik kabuğunda sekiz elektrona sahiptir ve her hidrojenin iki elektronlar). Burada da iki basit bağlantı yapılır.
Tüm atomların elektron alması gereken (hidrojen, ametaller ve yarı metaller) ve elektronların çiftler halinde paylaşıldığı bu tür kimyasal bağa denir. kovalent bağ.
Ancak iki tür kimyasal bağ daha vardır:
(1) iyonik bağ → bir atomdan diğerine kesin elektron transferi vardır. Bu tür bir bağ, metal atomları arasında oluşur (elektronları kaybetmeye eğilimlidirler). kararlı) ve hidrojen atomları, metal olmayanlar ve yarı metaller (elektron kazanma eğiliminde olan) kararlı).
Bir örnek sodyum klorürdür (NaCl - sofra tuzu), burada sodyum bir elektron kaybetme eğilimi olan bir metaldir, klor ise bir elektron kazanma eğilimi olan bir metal değildir. Böylece sodyum bağışlar(kırmızı ok)bir elektrondan klora, tuz oluşturan çok kararlı bir madde. Mezun olduklarından beri (siyah ok) zıt yüklere sahip kimyasal türler olan iyonlar (+ ve -), bir iyon yakındaki diğerini çeker ve sofra tuzundaki kristaller gibi çok sayıda iyondan oluşan iyonik kümeler oluşur.

İyonik bağ yoluyla sodyum klorür oluşumu
(2) Metal bağlantı → Metallerin (alüminyum, altın, gümüş, bakır vb.) bir nötron atomu kümesinden oluştuğu ve bir tür serbest elektron bulutu tarafından bir arada tutulan katyonlar (katyon oluşumunda kaybolan elektronlar) alıntı). Bu elektron bulutu (veya denizi), atomları bir arada tutacak metalik bir bağ görevi görecektir.
Bu tür kimyasal bağların yanı sıra oktet kuralı hakkında daha fazla ayrıntı için aşağıdaki ilgili makaleleri okuyun.
Zihin Haritası M.e Victor Ricardo Ferrreira
Kimya hocası
Jennifer Foğaça tarafından
Kimya mezunu
Kimya

İyonik bağ, iyonik bileşikler, iyonik aglomeralar, sodyum klorür, sofra tuzu, iyonik madde arasındaki düzenlemeler, elektrostatik çekim kuvvetleri, klorür anyonları, sodyum katyonları, polar çözücüler, pozitif iyonlar, katyonlar, negatif iyonlar, anyonlar.

