baz dır-dir inorganik madde İsveçli kimyacıya göre Svante Arrhenius, suya yerleştirildiğinde, fenomene maruz kalır iyonik ayrışma, serbest bırakılmasının olduğu iyonlar: katyon (Y+) ve hidroksit anyonu (OH-).

Arrhenius bazının genel formülü
Y grubu bir baz herhangi bir metal veya amonyum grubunun (NH4+), süreci temsil eden denklemde görülebileceği gibi, ayrışma sırasında katyonlar olarak suda salınır:
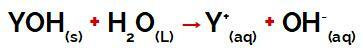
Bir bazın ayrışmasını temsil eden denklem
Aşağıda, sınıflandırma ve isimlendirme ile ilgili bazı çok önemli bilgilere bakın. bazlar.
1) Sınıflandırma ile ilgili bazların çözünürlüğü(için beceri çözmek suda)
bazlar çözünür: bileşimde alkali metal veya amonyum bulunur;
-
bazlar az çözünür: Sahip olmak alkali toprak metali kompozisyonda. Örnek: antasit ve müshil olarak yaygın olarak kullanılan magnezyum hidroksit;
Şimdi durma... Reklamdan sonra devamı var ;)
pratik olarak bazlar çözünmez: Bileşiminde başka herhangi bir metal var. Örnek: yaygın olarak antasit olarak kullanılan alüminyum hidroksit.
2) Sınıflandırma ile ilgili taban gücü(için beceri ayrılmak suda)
bazlar kuvvetli: bileşimde magnezyum hariç alkali veya toprak alkali metaller bulunur;
bazlar güçsüz: Bileşiminde başka herhangi bir metal var.
3) Temel isimlendirme
Bir üssü adlandırmak için aşağıdaki adlandırma kuralına uymanız yeterlidir:
Hidroksit + de + metal veya amonyum adı
Misal: Ca(OH)2 → kalsiyum hidroksit
Baz, IA, IIA veya IIIA ailelerine ait olmayan bir kimyasal elemente sahipse (ve bu, gümüş veya çinko), elementin adının önüne romen rakamlarıyla, hidroksil:
Misal: Ti (OH)4 → titanyum hidroksit IV
Benden. Diogo Lopes
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
GÜNLER, Diogo Lopes. "Baz nedir?"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm. 27 Haziran 2021'de erişildi.
Baz İsimlendirme, Sulu Çözelti, İyonik Ayrışma, Katyon, Anyon, Sodyum Hidroksit, Alüminyum Hidroksit, Demir Hidroksit, Bakır Hidroksit, Ferrik Hidroksit, Kalsiyum Hidroksit.