İçin bir sigma bağlantısını sınıflandırmak, bir molekülün yapısında onu nasıl tanıyacağını bilmek esastır. Sigma bağı aslında kovalent bir bağdır. iki eksik atomik orbital olduğunda oluşur (sadece bir elektron ile) aynı eksende iç içe geçmek. Bir örnek, bir p-tipi (sarmal) orbitalin başka bir p-orbital ile iç içe geçmesidir.

p-p sigma bağında iç içe geçen p orbitalleri
Uygulamada (egzersizlerde), bir sigma bağlantısının tanınması ve sınıflandırılması yapısal formülden yapılır Aşağıdaki yapısal temsilde olduğu gibi bir maddenin:

Hidrosiyanik asidin yapısal formülü
Bir sigma bağlantısını sınıflandırmadan önce, yapısal bir formülde nasıl tanınacağını bilmek gerekir. Bunun için sadece şunu unutmayın gibi yollar kovalent bağ temsil edilir: arama basit tek bir çizgi (-) ile gösterilir, çift iki (=) ve bağlantı ile temsil edilir üçlü üç (≡) ile temsil edilir. Sigma bağı, aşağıdaki gibi kovalent bağların üç temsilinden herhangi birinde bulunur:
Basit: bir sigma bağına sahiptir;
Çift: İki bağlantıdan sadece biri sigmadır;
üçlü: Üç bağlantıdan biri sigmadır.
Bir sigma bağlantısını nasıl tanıyacağınızı bilmek, bir sonraki adım onu nasıl sıralayacağınızı öğrenmektir. Bunun için bağa dahil olan her bir atomun eksik yörüngesinin ne olduğunu bilmeliyiz:
H - eksik s orbitalini sunar, dolayısıyla sınıflandırmada s ile temsil edilir.
Ametaller- tamamlanmamış bir p yörüngesine sahipler, bu nedenle sınıflandırmada aşağıdaki unsurlar dışında p ile temsil edilirler:
Karbon: Eksik yörüngeniz türüne bağlıdır. hibridizasyon acı çektiğini. Olasılıklar şunlardır: sp hibridizasyonu3 (dört basit arama ne kadar yapar), sp2 (iki tek ve bir çift bağ ne kadar yapar) veya sp (iki çift bağ veya bir tek ve bir üçlü bağı ne kadar gerçekleştirdiği). Böylece, bir sigma bağının sınıflandırılmasında Karbon, sp ile temsil edilebilir.3, sp2 veya yaptığınız aramaya bağlı olarak sp.
Berilyum:acı çekmek sp tipi hibridizasyon, bu nedenle, sınıflandırmada sp ile temsil edilir.
Bor:acı çekmek sp tipi hibridizasyon2, bu nedenle, sınıflandırmada sp ile temsil edilir.2.
Tüm bu bilgilerle en kolay kısım, bir yapıda bulunan sigma linklerini sınıflandırmaktır. Hadi bazı örneklere bakalım:
Örnek 1: sudaki sigma bağlantıları

Suyun yapısal formülü
Şimdi durma... Reklamdan sonra devamı var ;)
Yukarıdaki yapısal formül, suyun iki sigma bağı (iki basit), onlar olmak oksijen arasında (p ile temsil edilir) bu Hidrojen (s ile temsil edilir). Böylece, sınıflandırılmış iki sigma bağlantımız var:
s-p
Örnek 2: Fosfor triklorürde Sigma bağları

Fosfor triklorürün yapısal formülü
Yukarıdaki yapısal formül, fosfor triklorürün üç aramasigmalar (üç basit), onlar Fosfora girmek (p ile temsil edilir) bu klor (p ile temsil edilir). Böylece, sınıflandırılmış üç sigma bağlantımız var:
p-p
Örnek 3: bor triflorürde sigma bağları
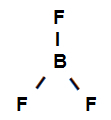
Bor triflorürün yapısal formülü
Yukarıdaki yapısal formül, bor triflorürün üç sigma bağlantısı (üç basit), onlar bora girmek (sp ile temsil edilir2) bu flor (p ile temsil edilir). Böylece, sınıflandırılmış üç sigma bağlantımız var:
p-sp2
Örnek 4: etanolde sigma bağları
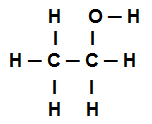
Etanol yapısal formülü
Yukarıdaki etanolün yapısal formülü şunu göstermektedir: sekiz çağrımız var sigmalar (sekiz basit bağlantı). Onlar:
Oksijen arasında bir (p ile temsil edilir) ve hidrojen (s ile temsil edilir). Böylece, bağlantı sigma s-p olarak sınıflandırılır.
İki karbondan biri yalnızca sigma bağlantıları gerçekleştiren (ve ardından sp ile temsil edilir3). Böylece, bağlantı sınıflandırılır sp3-P3.
Karbon arasında bir (sp ile temsil edilir3) ve oksijen (p ile temsil edilir). Böylece, sigma bağlantısı şu şekilde sınıflandırılır: p-sp3.
karbon arasında beş (sp ile temsil edilir3) ve hidrojen (s ile temsil edilir). Böylece, beşi de sınıflandırılır s-sp3.
Örnek 5: Dikloroeten içinde Sigma bağları

Dikloroeten yapısal formülü
Yukarıdaki Dikloroetenin yapısal formülü, beş sigma bağlantısı (dört tekli bağ ve çift bağlardan biri). Onlar:
İki karbondan biri iki tek ve bir çift bağ gerçekleştiren (ve sonra sp ile temsil edilir2). Böylece, sigma bağlantısı şu şekilde sınıflandırılır: sp2-P2.
Dört karbon arasında(sp ile temsil edilir2)ve hidrojen (s ile gösterilir). Böylece, dördü de sınıflandırılır s-sp2.
Benden Diogo Lopes Dias
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
GÜNLER, Diogo Lopes. "Bir sigma bağlantısının sınıflandırılması"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm. 28 Haziran 2021'de erişildi.
