kendini şöyle tanımlar hibridizasyon tamamlanmamış atomik orbitallerin birleşimi. Bir yörünge, yalnızca bir taneye sahip olduğunda eksik olarak sınıflandırılır. elektron iki yerine içinde. Eksik bir yörüngenin ve tam bir yörüngenin temsiline bakın:

Resim A'da tam bir yörüngemiz var; B görüntüsünde, tamamlanmamış bir yörünge.
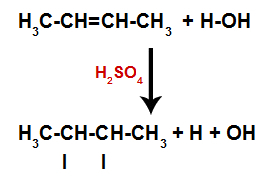
Hibridizasyon, Fosfor, Sülfür, Karbon vb. gibi bazı kimyasal elementlerle meydana gelen doğal bir olgudur. Karbonun hibridizasyonu bu elementin atomlarının dört kimyasal bağ yapabilmesini sağlar, yani karbon hibridizasyon fenomeninden geçtikten sonra sadece dört bağ yapar.
Fakat karbon neden hibritleşir ve dört bağ yapar? Bu fenomeni anlamak için, bu elementin elektronik dağılımını bilmeliyiz:
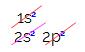
Karbonun elektronik dağılımında, 1s alt seviyesinin tamamlandığını (iki elektronlu), 2s'nin ise tamamlandığını görüyoruz. tamamlandı (iki elektronlu) ve 2p alt düzeyi eksik (p alt düzeyi altı elektronu destekler, ancak yalnızca iki). 2p elektronları temsili bir şekilde dağıtarak şunları yapmalıyız:
Şimdi durma... Reklamdan sonra devamı var ;)
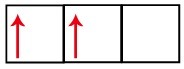
p alt seviyesinin üç yörüngesi vardır - karbon durumunda, ikisi eksik ve biri boştur. Bu nedenle, eksik orbitallerin sayısı her zaman bağlantıların sayısını belirlediğinden, bu öğe yalnızca iki bağlantı gerçekleştirmelidir.
Ancak dış ortamdan enerji alırken karbonda bulunan elektronlar uyarılır. Böylece, alt düzey 2s'de bulunan elektronlardan biri, alt düzey p'nin boş olan yörüngesine hareket eder:
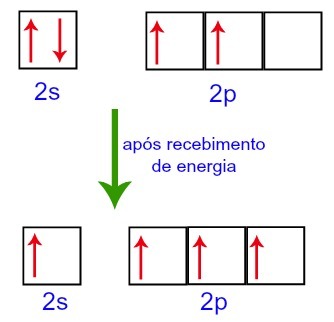
Dış ortamdan enerji almadan önce ve sonra Karbon Orbitalleri
Böylece, karbon ikinci seviyesinde dört tamamlanmamış orbital ile bırakılır. Ardından, 2s alt seviyesinin yörüngesi, fenomeni yapılandıran üç p yörüngesine katılır. hibridizasyon.
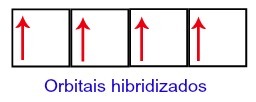
Hibridizasyondan sonra karbon orbitalleri
Benden Diogo Lopes Dias
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
GÜNLER, Diogo Lopes. "Karbon hibridizasyonu"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm. 28 Haziran 2021'de erişildi.