*Arrhenius Teorisi:
Sulu ortamda elektriksel iletkenlik ile yaptığı deneylere dayanarak, kimyasal, fiziksel ve matematiksel İsveçli Svante August Arrhenius (1859-1927), 1884'te asitleri ve asitleri tanımlamak için aşağıdaki kavramları önerdi: bazlar:

Yani, genel olarak, elimizde:
H+ + H2O → H3Ö+
Örnekler:
HC1 + H2O → H3Ö++ Cl-
HNO3+ H2O → H3Ö+ + HAYIR3-
H2SADECE4+ 2H2O → 2H3Ö+ + işletim sistemi42-

Örnekler:
NaOH → Na + + OH-
Ca(OH)2 →Ka2+ + 2OH-
*Brönsted-Lowry teorisi:
Bağımsız olarak, Danimarkalı Johannes Nicolaus Brönsted (1879-1947) ve İngiliz Thomas Martin Lowry (1874-1936), aynı yıl Brönsted-Lowry Teorisi olarak bilinen başka bir asit-baz teorisini önerdi. Takip etme:

Bu durumda hidrojen iyonu bir proton olarak kabul edilir. Bu, hidrosiyanik asidin suya bir proton bağışladığı ve bu nedenle bir baz görevi gördüğü aşağıdaki reaksiyonda görülür:
HCN + H2O → CN- + H3Ö+
Bu reaksiyon hidronyum iyonu (H3Ö+) CN iyonuna bir proton bağışlayabilir-. Böylece hidronyum iyonu (H3Ö+) bir asit görevi görür ve CN- baz olarak.
CN- + H3Ö+→ HCN + H2Ö
*Lewis teorisi:
Bu teori Amerikalı kimyager Gilbert Newton Lewis (1875-1946) tarafından oluşturuldu ve şunları söylüyor:

Şimdi durma... Reklamdan sonra devamı var ;)
Bu teori yeni bir kavram getirir, daha kapsamlıdır, ancak Brönsted-Lowry teorisini geçersiz kılmaz. Her Lewis asidi için bir Brönsted asididir ve bu nedenle her Lewis bazı bir Brönsted bazıdır. Bunun nedeni, bir protonun elektron almasıdır, yani bir Lewis asidi, bir Lewis bazında yalnız bir çift elektrona katılabilir.
Lewis için, bir asit-baz reaksiyonu, daha kararlı bir koordineli kovalent bağın oluşumundan oluşur. Böylece bir Lewis bazı, bir Lewis bazına bir çift elektron bağışladığında, ikisi de birer elektron oluşturur. örnekte olduğu gibi her iki elektronun da atomlardan birinden geldiği koordinat kovalent bağı feryat:
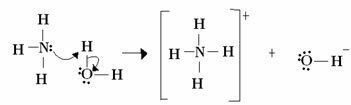
Bu durumda amonyak, iki elektronunu protona bağışladığı ve dolayısıyla protonun alıcısı olduğu için Lewis ve Brönsted bazı gibi davranır. Ayrıca hidrojen (proton) ile amonyak arasında kovalent bir bağ oluştu.
Su, Lewis asididir ve Brönsted asidi, protonu bağışlayıp elektron aldığı için, sudan oluşan hidroksit içindeki oksijenin nasıl fazladan bir çift elektrona sahip olduğuna dikkat edin.

Jennifer Foğaça tarafından
Kimya mezunu
Brezilya Okul Takımı.
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
FOGAÇA, Jennifer Rocha Vargas. "Arrhenius, Brönsted-Lowry ve Lewis asit-baz teorileri"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm. 28 Haziran 2021'de erişildi.
