pil kimyasal enerjinin kendiliğinden elektrik enerjisine dönüştüğü bir sistemdir.
1836'da İngiliz kimyager ve meteorolog John Frederic Daniell (1790-1845) o sırada bilinenden farklı bir yığın inşa etti: Alessandro Volta yığını. Bu yığında o Bu metalin katyonları tarafından oluşturulan bir tuzun sulu çözeltisine daldırılmış bir metalden oluşan sistemler olan birbirine bağlı iki elektrot.
Elektrotlardan biri olan bakır elektrot, bir bakır sülfat çözeltisine (CuSO4) batırılmış bir bakır plakadan oluşuyordu. Diğer elektrot, bir çinko sülfat (ZnSO4) çözeltisine daldırılmış bir çinko levhadan oluşan bir çinko elektrottu.
Bu iki elektrot, bir lamba içeren bir elektrik devresi ile birbirine bağlandı, çünkü eğer açılırsa, bir elektrik akımının ortaya çıktığını gösterecekti.
Ayrıca aralarında bir tuz köprüsü vardı. Bu köprü, örneğin potasyum klorür (KCl (aq)) gibi yüksek oranda çözünür bir tuzun konsantre sulu çözeltisini içeren U şeklinde bir cam tüpten oluşuyordu. Tüpün uçları pamuk veya agar ile kaplanmıştır.
Aşağıda, Daniell hücresi olarak bilinen bu hücrenin veya elektrokimyasal hücrenin yapısını görüyoruz. Her elektrotun yarım hücre olarak adlandırıldığını hatırlamak.
Devre kapalıyken lamba yanar ve bir süre sonra, çinko levha paslanır ve kütlesi azalır, bakır levha ise tam tersidir, kütlesi artar (aşağıdaki şekilde gösterildiği gibi). Şuna da dikkat çekiliyor: Zn iyonlarının mol/L cinsinden konsantrasyonunda bir artış var2+ ve Cu iyonlarında azalma2+.
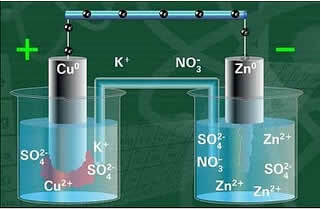
Daniell'in Yığın Şeması.
Bu neden oluyor?
Şimdi durma... Reklamdan sonra devamı var ;)
Anlamak için, her elektrotta ayrı ayrı gerçekleşen reaksiyonlara bakalım.
Çinko elektrotta aşağıdaki denge reaksiyonu meydana gelir:
Zn(ler) ↔ Zn2+(İşte) + 2 ve-
Bu, metalik çinkonun (plakadan) oksidasyona uğradığı, yani çinko katyonuna (çözeltiden) iki elektron bağışladığı ve Zn2+ olduğu anlamına gelir. Bunun tersi de meydana gelir, çözeltide bulunan çinko katyonu, çinko tarafından bağışlanan iki elektronu alır ve metalik çinko olur. Bu nedenle, kesintisiz bir oksidasyon ve indirgeme süreci vardır.
Aynısı, dinamik dengede global reaksiyona sahip olacak bakır elektrot için de geçerlidir: Cu(s) ↔ Cu2+(İşte) + 2 ve-
Daniell, bu iki elektrotu birbirine bağlarsa, daha reaktif olanın elektronlarını kendi çözeltisindeki katyonlarla yapmak yerine daha az reaktif olan katyona bağışlayacağını fark etti. Bu durumda çinko en reaktif olanıdır ve oksidasyona uğrar, bakıra elektron verir, dolayısıyla kütlesinde azalma olur. Oksidasyona uğrayan elektrot, anot adı verilen negatif kutuptur. Bakır elektrot indirgeme işlemine tabi tutulur, bakır katyonu çinkodan iki elektron alır ve katot (pozitif kutup) olarak adlandırılır.
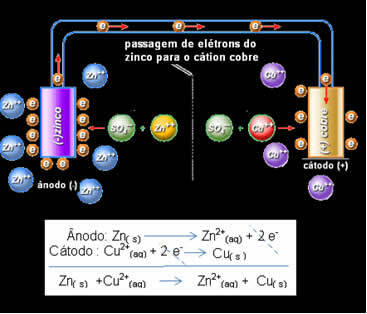
Elektron geçişi ve Daniell'in yığın küresel denklemi.
Yukarıda, iki yarı reaksiyonun eklenmesiyle elde edilen bu yığın için global denklemimiz var. Temsili veya kimyasal gösterimi aşağıdaki kurala göre yapılır:

Yani Daniell'in yığını için elimizde:
Zn / Zn2+// eşek2+ / eşek
Jennifer Foğaça tarafından
Kimya mezunu
Brezilya Okul Takımı
fizikokimyasal - Kimya - Brezilya Okulu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
FOGAÇA, Jennifer Rocha Vargas. "Danill'in Yığını"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. 28 Haziran 2021'de erişildi.

