Metinlerde gösterildiği gibi "Kimyasal Elementlerin Elektromanyetik Spektrumu" ve "Emisyon ve Soğurma Spektrumları ve Kirchhoff Kanunları”, her kimyasal elementin süreksiz emisyon spektrumları farklıdır.

Dolayısıyla, aşağıda bu elementlerden bazılarının farklı spektrumlarına sahibiz:

Böylece Danimarkalı fizikçi Niels Böhr (1885-1962), bunun bu elementlerin her birinin atomunun yapısıyla ilgili olabileceğini fark etti. Böylece Rutherford'un modelini tamamlayan, ancak atom çekirdeğindeki çevreleyen elektronların davranışına odaklanan bir atom modeli önerdi.
Bir süre önce, Max Planck (1858-1947), elektronların nicelenmiş, onlar anlamında sanki küçük enerji paketleriymiş gibi belirli miktarda enerji yayar ve emerdiye seslendi ne kadar (kuantum, tekil olarak).
Böylece, Böhr aşağıdakileri önerdi: her elementin farklı bir spektrumu olduğundan, her elementin atomunda elementten elemente sabit ve farklı enerjilerde elektronlar bulunur.
Her elektron sadece belirli bir yörüngede kalabilir, çünkü bu yörüngelerin her birinde elektron sabit, iyi tanımlanmış ve karakteristik bir enerjiye sahiptir. Elektron sadece ilgili enerjiye sahip olduğu enerji seviyelerini işgal edebilir.
Elektronlar kuantize olduğu için spektrumlar süreksizdir.
Bir elektron ancak enerji emerse seviyeleri değiştirebilir. Örneğin, bir Bunsen brülöründe bir sodyum tuzu yaktığınızda, elektronlara enerji sağlıyorsunuz. Bir kuantum enerjiyi emerken, elektron uyarılmış durumda kalarak daha enerjik başka bir seviyeye atlar. Bununla birlikte, temel durum daha kararlıdır, bu nedenle bu elektron emilen enerjiyi yayar ve orijinal yörüngesine geri döner. Bu enerjiyi ışık şeklinde görselleştirilebilen elektromanyetik dalgalar şeklinde yayar. Sodyum durumunda, bu ışık yoğun sarı renktedir. Böylece, bu dalgalar bir prizmadan geçtiğinde, süreksiz sodyum spektrumu elde edilir.
Yani, Böhr için, Elementlerin süreksiz tayfında görünen her parlak çizgi, elektron bir dış seviyeden çekirdeğe daha yakın bir seviyeye döndüğünde salınan enerjiyi gösteriyordu.
Aşağıdaki şekil bu sorunun daha iyi anlaşılmasına yardımcı olur:
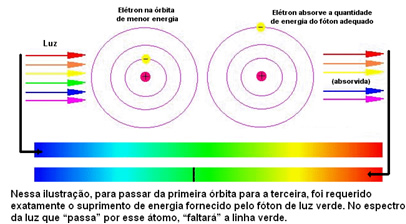
Her elementin atomlarına sadece enerji katmanlarına karşılık gelen belirli enerji değerlerine izin verildiğinden, her element için farklı bir spektrum vardır.
Jennifer Foğaça tarafından
Kimya mezunu
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm
