Gaz ve Buhar
Gaz ve buhar arasındaki fark kritik sıcaklıktan verilir. Buhar, artan basınçla sıvılaştırılabilen gaz halindeki bir maddedir. Gaz aynı değildir. Basit bir basınç artışıyla sıvılaştırılamayan bir sıvıdır. Bu, gazı buhardan farklı kılar.
Gazların Davranışı
Gaz halindeki belirli bir madde, sıcaklığı kritik sıcaklıktan yüksekse gazdır, sıcaklık kritik sıcaklığa eşit veya daha düşükse madde buhardır.
Helyum, nitrojen ve oksijen gibi normalde bildiğimiz gerçek gazların her birinin farklı ve belirli moleküler özellikleri vardır. Ancak hepsini yüksek sıcaklıklara ve düşük basınçlara koyarsak çok benzer davranışlar göstermeye başlarlar. Gazların çalışmasında, gerçek gazlarınkine benzer davranışa sahip, pratikte mevcut olmayan basit bir teorik model benimsenmiştir. Bu yaklaşım, basınç düştükçe ve sıcaklık arttıkça daha iyi olur. Bu gaz modeli denir mükemmel gaz.
17. ve 19. yüzyıl civarında, üç bilim adamı (Jacques Charles, Louis J. Gay-Lussac ve Paul E. Clayperon), gazların davranışını inceledikten sonra, ideal gazlar olarak da adlandırılan mükemmel gazların davranışını yöneten yasaları geliştirdi. Onlar tarafından belirlenen yasalar, mükemmel gazın “dış” davranışının kurallarını belirler ve buna yol açar. sadece bunlarla ilişkili fiziksel nicelikleri sayar: hacim, sıcaklık ve basınç.
Mükemmel gazların genel yasası
Mükemmel gazlar için genel yasayı belirleyen ifade şu şekilde görülebilir:
Şimdi durma... Reklamdan sonra devamı var ;)
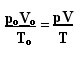
nerede pÖ, VÖ ve TÖ sırasıyla başlangıç basıncı, başlangıç hacmi ve başlangıç sıcaklığıdır. Bu, bir gazın değişkenleri değiştiğinde kullanılan bir ifadedir.
Boyle Kanunu
Fizikçi ve kimyager Robert Boyle, sıcaklığı sabit tutulduğunda bir gazın geçirdiği dönüşümleri yöneten yasayı belirleyen kişiydi. Onun yasası, bir gaz izotermal bir dönüşüme uğradığında, basıncının işgal edilen hacimle ters orantılı olduğunu söylüyor. Bu yasadan anlıyoruz ki nasıl TÖ = T Zorundayız:
PÖVÖ = pV
Charles'ın kanunu
Charles yasası, mükemmel bir gazın sabit hacme dönüşümlerini yöneten yasadır. Bu dönüşümlere izokorik veya izometrik dönüşümler denir. Bu yasaya göre, mükemmel bir gaz kütlesi izokorik bir dönüşüm geçirdiğinde, basıncı mutlak sıcaklığıyla doğru orantılıdır. Matematiksel olarak bu yasa aşağıdaki gibi ifade edilebilir:

nerede pÖ ve TÖ sırasıyla başlangıç basıncı ve başlangıç sıcaklığıdır.
Gay-Lussac Yasası
Gay-Lussac yasası, mükemmel bir gazın sabit basınçta dönüşümlerini yöneten yasadır. Bu yasa, Gay-Lussac adını taşımasına rağmen, fizikçi ve kimyager A.C. Charles tarafından zaten keşfedilmişti. Yasaya göre, bir gaz izobarik dönüşüme uğradığında, gazın hacmi mutlak sıcaklığı ile doğru orantılıdır. Matematiksel olarak bu yasa aşağıdaki gibi ifade edilebilir:

nerede VÖ ve TÖ sırasıyla ilk hacme ve ilk sıcaklığa karşılık gelir.
Marco Aurélio da Silva'nın fotoğrafı.
Daha fazla gör!!
Gaz Dönüşümleri
Gaz dönüşümlerinin ne olduğunu bilin.
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
SANTOS, Marco Aurélio da Silva. "Gazların Çalışması"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. 27 Haziran 2021'de erişildi.

