Bir çözelti karışımında kimyasal bir reaksiyonun meydana gelmesi için, reaksiyon aralarında meydana geldiğinden, çözünenleri aynı olmamalıdır.
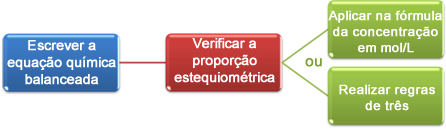
Laboratuarlarda ve kimya endüstrilerinde, çoğu karışım reaksiyonların oluşumundan meydana gelir ve bu nedenle bu reaksiyonların stokiyometrisini bilmek esastır. Bu, reaksiyonların nasıl eşitleneceğini bilmek ve dengeli denklemin katsayıları tarafından verilen reaktanların ve ürünlerin mol sayısındaki oranını bilmek anlamına gelir.
Bu detayları bilirsek, nihai çözeltinin nötr, asidik veya bazik olup olmadığını belirleyebileceğimiz gibi, ürünün mol/L cinsinden konsantrasyonunu da belirleyebileceğiz.
Bunun nasıl olduğunu anlamak için, bir asit ve bir baz arasındaki reaksiyon örneğine bakın:
• 0,7 mol/L'de 30 mL sodyum hidroksit (NaOH) ile 0,3 mol/L'de 70 mL hidroklorik asit (HCl) arasında karıştırın.
Gerçekleşen reaksiyon aşağıdaki gibidir:
1 NaOH + 1 HCl → 1 NaCl +1 H2Ö
Reaksiyon oranının 1:1 olduğuna dikkat edin. Karışımın da bu oranda olup olmadığını görelim ve nötr, asidik veya bazik bir karışım olup olmadığını belirleyelim. Bunun için reaktiflerin mol (n) sayılarını bulmak gerekir:
HayırNaOH = MNaOH. VNaOH
HayırNaOH = 0.7 mol/L. 0.03 litre
HayırNaOH =0.021 mol
HayırHCl = MHCl. VHCl
HayırHCl = 0,3 mol/L. 0.07 litre
HayırHCl =0.021 mol
Şimdi durma... Reklamdan sonra devamı var ;)
Böylece sahibiz:
1 NaOH + 1 HCl → 1 NaCl +1 H2Ö
Oran: 1 mol 1 mol 1 mol
Mol sayısı: 0.021 mol 0.021 mol 0.021 mol
Bu, reaksiyonun, fazla asit veya baz olmadığı için nötr kaldığı, stokiyometrik orana uyduğu anlamına gelir.
Oluşan tuzun mol/L (M) cinsinden konsantrasyonu, çözeltinin hacminin asit ve baz hacimlerinin toplamı olduğunu hatırlayarak (30 mL + 70 mL = 100 mL = 0.1L) aşağıdaki formülle bulunabilir. ):
M = Hayır
V
M = 0.021mol
0.1L
M = 0.21 mol/L
Bununla birlikte, daha fazla miktarda NaOH'yi aynı miktarda HCl ile karıştıracak olsaydık, NaOH'nin mol sayısının stokiyometrik orana uymayacağını ve fazla kaldığını görürdük. Böylece, nihai çözümün temel bir karakter sunacağını bilirdik.
Bu kavram, adı verilen bir teknikte yaygın olarak kullanılmaktadır. titrasyonBilinmeyen bir çözeltinin konsantrasyonunun, bilinen konsantrasyondaki bir çözelti ile reaksiyonu (bir gösterge yardımıyla) ile belirlendiği.

Jennifer Foğaça tarafından
Kimya mezunu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
FOGAÇA, Jennifer Rocha Vargas. "Kimyasal reaksiyonların meydana geldiği çözeltilerin karışımı"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-ocorrencia-reacoes-quimicas.htm. 28 Haziran 2021'de erişildi.