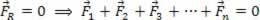Energiinre är summan av kinetiska energier och potential relaterad till rörelsen av de ingående atomerna och molekylerna i en kropp. Den inre energin är också direkt proportionell mot temperatur av kroppen. Det är en skalär kvantitet mätt i Joule (SI) och bestämd som en funktion av variabler som tryck (P), volym (V) och temperatur termodynamik (T) för ett system, i Kelvin (K).
Ju högre kroppens temperatur, desto större är dess inre energi, desto större är dess förmåga att göra något arbete. Dessutom ges till exempel monoatomiska gasers inre energi uteslutande av summan av rörelseenergi av varje atom i gasen. När man arbetar med molekylära gaser, såsom diatomiska gaser, måste man ta hänsyn till molekylära interaktioner och, för detta bestäms den inre energin av summan av molekylernas kinetiska energi med den potentiella energin som finns mellan de.
Sluta inte nu... Det finns mer efter reklam;)
Intern energi av ideala monoatomiska gaser
Eftersom det inte finns någon interaktion mellan atomerna i en ideal monoatomisk gas beror dess inre energi uteslutande på två variabler: antalet mol (n) och gastemperaturen (T). Kolla på:

U - inre energi
Nej - antal mol
R - universell konstant av perfekta gaser
T - temperatur
I ekvationen ovan, R den har en modul på 0,082 atm. L / mol. K eller 8,31 J / mol. K (SI). Vi kan också skriva ovanstående ekvation i termer av andra kvantiteter, såsom tryck och volym. För det måste vi komma ihåg Clapeyrons ekvation, används för ideala gaser.

Genom att ersätta den ovanstående ekvationen för den föregående kommer vi att ha följande uttryck för beräkning av den interna energin:

Seockså:Vad är en perfekt gas?
Med hänsyn till ovanstående ekvationer är det möjligt att bestämma ett samband mellan den kinetiska energin hos atomerna i en ideal monoatomisk gas och dess temperatur. För detta kommer vi att konstatera att den kinetiska energin för denna typ av gas är rentkinetik. Kolla på:

m - pasta
Nej - molnummer
M - molär massa
I många situationer är det intressant att veta hur man beräknar variationen av den interna energin (ΔU) för en gas, eftersom denna mängd anger om gasen har mottagit eller gav in energi. Om variationen i gasens interna energi har varit positiv (ΔU> 0) kommer gasen att ha fått energi; annars ((U <0) kommer gasen att ha gett upp en del av sin energi.

Intern energivariation när det gäller gasvolymvariation.
Intern energi för diatomiska gaser
För ideala diatomiska gaser ges den inre energin genom en något annan ekvation.

Intern energi i termodynamiska transformationer och cykler
Enligt 1: a termodynamiklagenkan den inre energin hos en idealgas variera i vissa termodynamiska transformationer, beroende på mängden värme som utbyts mellan omgivningen och systemet, liksom det arbete som utförs av eller på systemet.

F - värme
τ - arbete
Låt oss sedan titta på den form som denna lag har för vissa speciella termodynamiska transformationer.
Seockså:Termiska maskiners historia
→ Intern energi: isotermisk transformation
På isotermisk transformation, det sker ingen temperaturförändring och därför förblir den inre energin konstant.

I detta fall förvandlas hela mängden värme som utbyts med systemet till arbete och tvärtom.
→ Intern energi: isovolumetrisk transformation
På isovolumetrisk transformationär det inte möjligt att utföra arbete, eftersom systemet är inneslutet i en styv och billig expansionsbehållare. I detta fall varierar hela mängden värme som utbyts med systemet direkt dess interna energi.

→ Intern energi: isobar transformation
I denna typ av transformation utsätts systemet för en konstant tryckdärför kan det arbete som utförts av honom eller för honom beräknas analytiskt.

→ Intern energi: adiabatisk transformation
I adiabatiska omvandlingar, det finns inget värmeväxling mellan systemet och dess omgivningar, därför beror variationen på intern energi uteslutande på det arbete som utförs av eller på systemet.

Intern energi i cykliska processer
I varje cyklisk process är det termodynamiska tillståndet för ett system, representerat av dess tryck-, volym- och temperaturvariabler (P, V, T). transformeras, men hamnar tillbaka till det ursprungliga tillståndet (P, V, T), därför är variationen av intern energi i denna typ av process alltid noll (U = 0).
Seockså:Cykliska transformationer
Titta på diagrammet nedan, som visar tre distinkta termodynamiska transformationer mellan tillstånd A och B.

Eftersom de tre transformationerna (I, II och III) lämnar tillstånd A och går till tillstånd B, måste den interna energivariationen vara lika för dem alla, därför:

Interna energiövningar
1) Två mol av en idealisk kiselgas, med en molmassa lika med 24 g / mol, finns vid en temperatur av 500 K i en sluten, styv behållare med en volym lika med 10-3 m³. Bestämma:
a) Modulen för den inre energin för denna gas i joule.
b) Trycket som gasen utövar på behållarens väggar.
Upplösning:
De) Eftersom det är en idealisk och diatomisk gas kommer vi att använda formeln nedan för att beräkna dess inre energi:

Om vi tar de uppgifter som informerades i träningsuttalandet kommer vi att ha följande beräkning att lösa:

B) Vi kan bestämma det tryck som gasen utövar när vi känner till behållarens volym: 10-3 m³. För att göra detta använder vi följande formel:

Av mig Rafael Helerbrock