DE Oktettteori säger att för att en atom av ett kemiskt grundämne ska vara stabil måste den erhålla den elektroniska konfigurationen av en ädelgas, det vill säga den måste ha åtta elektroner i valensskalet eller två elektroner om atomen bara har det första elektronskalet. (K).
Beryllium har ett atomnummer lika med 4. Därför har din atom fyra elektroner och dess elektroniska fördelning i marktillstånd ges av:

Beryllium elektronisk konfiguration
Detta betyder att beryllium har 2 elektroner i sitt sista skal, från 2A-familjen (jordalkalimetaller). Således skulle det ha en tendens att donera dessa två elektroner, få laddningen 2+, det vill säga det skulle ha en tendens att bilda jonbindningar.
Det observeras emellertid att berylliumatomer bildar kovalenta bindningar, med elektrondelning, såsom visas i föreningen bildad nedan, berylliumhydrid (BeH2):
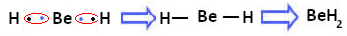
Bildning av kovalenta bindningar av beryllium med väte
Observera att beryllium i detta fall är stabilt med mindre än åtta elektroner i sitt valensskal, eftersom dela sina elektroner som väteatomer, den har nu fyra elektroner i sin sista lager. Det är därför en
undantag från oktettregeln.Men kovalent bindning sker vanligtvis eftersom elementet har ofullständiga orbitaler. Till exempel, som visas nedan, har väte en ofullständig omloppsbana, så det gör bara en kovalent bindning. Syre har två ofullständiga orbitaler och bildar två kovalenta bindningar. Kväve har i sin tur tre ofullständiga orbitaler och gör följaktligen tre kovalenta bindningar:
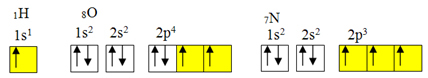
Elektroniska fördelningar av väte, syre och kväve
Men som redan visat har beryllium inte ofullständiga orbitaler.
Sluta inte nu... Det finns mer efter reklam;)
Så varför gör det kovalenta bindningar?
Förklaringen finns i hybridiseringsteori, som säger det när en elektron från en orbital tar emot energi, "hoppar" den till en yttersta tom orbital, förblir i upphetsat tillstånd och därmed sker fusion eller blandning av ofullständiga atomorbitaler, alstrande hybridorbitaler som är ekvivalenta med varandra och skiljer sig från de ursprungliga rena orbitalerna.
Till exempel, i fallet med beryllium, mottar en elektron från undernivå 2s energi och passerar till en subnivå 2p omlopp som var tom:

Beryllium upphetsat tillstånd för bildandet av hybridorbitaler
På detta sätt har beryllium två ofullständiga orbitaler, som kan göra två kovalenta bindningar.
Observera att den ena banan är i ett "s" undernivå och den andra i "p", så bindningarna som beryllium skulle utföra borde vara olika. Detta är dock inte vad som händer, för med fenomenet hybridisering, dessa ofullständiga orbitaler som bildas kommer att blandas och generera två kallade orbitaler hybrider eller hybridiserad, som är lika med varandra. Eftersom dessutom dessa två hybridorbitaler kommer från en "s" -bana och en "p" -bana, säger vi att denna hybridisering är av typen sp:

Beryllium sp hybridisering bildning
Eftersom hybridorbitalerna är desamma kommer de kovalenta bindningarna som beryllium gör med väteatomerna att vara desamma:

Interpenetrationer av hybridberylliumorbitaler med orbitaler av väten
Observera att det sedan skapar två sigma-bindningar som är av typen s-sp (σs-sp).
Av Jennifer Fogaça
Examen i kemi


