Amerikansk kemist Gilbert N. Lewis (1875-1946) föreslog oktettregeln, som säger:
"Atomer med olika element skapar kemiska bindningar, donerande, mottagande eller delande elektroner för att förvärva den elektroniska konfigurationen av ädelgas, det vill säga med 8 elektroner i det sista skalet (eller med 2 elektroner när det gäller de atomer som bara har ett elektronskal, som sker med väte)."
År 1916 föreslog Lewis att förbli stabil, nå oktetten eller duetten, de element som utgör molekylära ämnen utföra en delning av elektronpar. Dessa ämnen bildas endast av atomer av väte, icke-metaller och halvmetaller, allt med tendens att ta emot elektroner. Därför finns det inget sätt för någon av dem att donera någon elektron (som sker med metaller i jonbindningar), utan alla behöver ta emot, så de delar sina elektroner genom en kovalent bindning eller molekyl.
Således föreslog Gilbert Lewis ett sätt att representera den kovalenta eller molekylära bindningen, som blev känd som Lewis-formel. Hon kallas också
elektronisk formel eller ännu, Lewis elektroniska formel, eftersom dess huvudsakliga kännetecken är att det visar elektronerna i valensskalet för varje atom och bildandet av elektroniska par.Varje elektron representeras av en punkt., som omger symbolen för motsvarande kemiska element. Endast valensskalelektronerna finns runt elementet.
Som visas i tabellen nedan, för att veta mängden elektroner i valensskalet, känner du bara till det periodiska systemet:
Sluta inte nu... Det finns mer efter reklam;)

I Lewis-formeln, varje delat elektronpar representerar en kemisk (kovalent) bindning, där elektronerna möts i det område av elektrosfären som är gemensamt för varje atompar som är sammanfogade. Därför placeras de i representationen sida vid sida.
Låt oss till exempel ta reda på vad Lewis-formeln är för vätgas, vars molekylformel är: H2.
Varje väteatom har bara en elektron i valensskalet, eftersom detta element tillhör familj 1 i det periodiska systemet. Var och en behöver ta emot ytterligare en elektron, för att vara stabil, med två elektroner i K-elektronskalet. Så de delar sina elektroner och båda får två. Se:
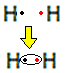
Detta är Lewis-formeln för vätgasmolekylen.
Syre har sex elektroner i sitt elektronskal, så var och en behöver ta emot ytterligare två elektroner för att vara stabila, med åtta elektroner. Därför är Lewis-formeln för syrgasmolekylen:

Se till att det finns två länkar, eftersom det finns två delade par.
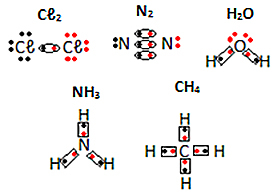
Se andra exempel på elektroniska formler för molekylära ämnen nedan:
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Lewis Electronic Formula"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm. Åtkomst den 28 juni 2021.
Kols rumsliga formel, Lewis elektroniska formel, planstruktur, elektroniska par, bindning kovalent, valenslager, utveckling av atommodellen, molekylformel, strukturformel, formler tredimensionell.
Kemiska formler, platt strukturformel, Couper strukturformel, trippelbindning, gas kväve, elektronisk formel, Lewis-formel, molekylformel, enkelbindning, dubbelbindning, gas kolsyra.
Kemi
Molekylära ämnen, koktemperatur, kontaktyta, kokpunkt, intermolekylära attraktionskrafter, kemiska bindningar, molekylära föreningar, kovalenta kemiska bindningar, jonbindningar, metallbindningar, fysiska tillstånd dålig