Enligt termodynamikens första lag, i vilken termodynamisk process som helst mängden värme F mottaget av ett system är lika med det arbete som utförs plus variationen av dess inre energi.
När trycket är konstant används den värme som systemet byter mot det externa mediet för arbete och för att ändra den inre energin. I många praktiska situationer utsätts systemen för atmosfärstryck, som i fallet med en kemisk reaktion. Figuren ovan visar PV-diagrammet för denna typ av process.
I detta fall, i ekvationen till den första lagen,
Q = τ + ∆U
ingen av villkoren är noll. Arbetet är skrivet som en funktion av volymvariation volymV, såsom:
τ = P.∆V
För det specifika fallet med en ideal monoatomisk gas kan energin skrivas enligt följande:

Därför kan vi skriva den första lagen om termodynamik som en funktion av AV:


Värmen som utbyts med mediet är (5/2) P. AV, och 40% av totalen - vilket motsvarar P. AV - används för att utföra arbete; och (3/2) P.ΔV, vilket motsvarar 60% av totalen, används för att ändra den inre energin. Detta resultat gäller för en ideal monoatomisk gas.
Värme är relaterat till temperaturvariation (med idealgaslag) av:
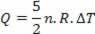
Således kan den tillförda värmen beräknas av temperaturförändringen eller av volymförändringen.
Av Domitiano Marques
Examen i fysik
Källa: Brazil School - https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm
