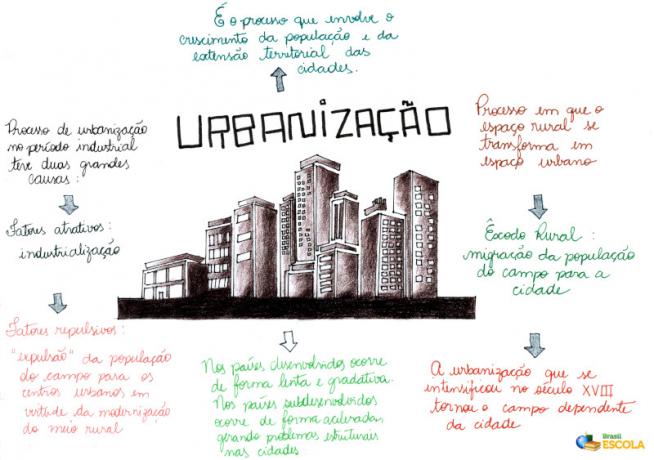
DE hydrolys konstant (Kh) avser a kemisk balans upprättas från hydrolys av ett salt (kemisk reaktion som involverar ett lösligt salt och vatten).
Som konstanten för någon annan jämvikt, uttrycket av hydrolys konstant konstrueras av produkten av produktkoncentrationer dividerad med produkten av reagenskoncentrationer, enligt följande:
Kh = [Produkter]
[reagenser]
Att arbeta med hydrolyskonstanten innebär kunskap om tre viktiga fenomen:
- Dissociation av salter;
- Vattenjonisering;
- Salthydrolys.
Dissociation av salter
När ett lösligt salt tillsätts till vatten, dissocierar det och frigör en annan katjon än hydronium (H +) och annan anjon än hydroxyl (OH-).

För att påminna dig om ett salt är eller inte är lösligt i vatten, Klicka här och studera saltlöslighetstabellen.
vattenjonisering
Vatten är ett ämne som naturligt genomgår fenomenet självjonisering, det vill säga det producerar en hydroniumkatjon och en hydroxylanjon.

vattenjonisering ekvation
hydrolys av ett salt
Som ett lösligt salt släpper det ut joner i vattnet och vattnet genomgår jonisering och producerar
joner i mitten kan reaktionen (hydrolys) mellan saltjonerna och vattenjonerna äga rum. När denna reaktion inträffar är de möjliga interaktionerna:- Katjon av saltet med anjonen av vatten (bildning av en bas);
- Saltjon med katjon av vatten (bildande av salt);
Ovanstående interaktioner kommer endast att ske om basen eller syran som bildas är svag.
Sluta inte nu... Det finns mer efter reklam;)
Se ett exempel på hydrolys av ett salt:
→ Hydrolys av ammoniumhypoklorit (NH4ClO)
När ammoniumhypoklorit tillsätts till vatten upplöses och dissocieras och frigör ammoniumkatjonjoner (NH4 +) och hypokloritanjonen (ClO-):

Ekvation som visar jonerna som frigörs vid dissociationen av ammoniumhypoklorit
Eftersom vatten, när det genomgår jonisering, producerar H + och OH- har vi i lösningen två katjoner och två anjoner som kan reagera. NH4 + -katjonen reagerar endast med OH-anjonen eftersom den bildar en svag bas (NH4OH). ClO-anjonen reagerar endast med H + -katjonen eftersom den bildar en svag syra (HClO).

Ammoniumhypoklorithydrolysjämviktsekvation
Konstruktion av uttrycket av hydrolyskonstanten
Konstruktionen av hydrolyskonstanten för ett salt beror uteslutande på hydrolysekvationen för det saltet. Hydrolysen av ammoniumhypoklorit, till exempel, arbetade med i föregående artikel genererade följande ekvation:

Ammoniumhypoklorithydrolysjämviktsekvation
Hur man bygger uttrycket för hydrolys konstant tar hänsyn till produkter och reagenser skulle uttrycket för konstanten vara:
Kh = [HClO]. [NH4OH]
[ClO -]. [NH4 +]
OBS: Vatten deltar inte i ekvationen eftersom det är ett flytande reagens och också för att det är det grundläggande sättet för förekomst av hydrolys, det vill säga det är konstant.
Av mig Diogo Lopes Dias
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
DAGAR, Diogo Lopes. "Vad är en hydrolyskonstant?"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm. Åtkomst den 28 juni 2021.
Vad är kemi?

Förstå vad Kp är, jämviktskonstanten i termer av tryck, och vet hur man får det genom att använda tryck partier av alla gaser som finns i en kemisk jämvikt, som kan finnas i atmosfärer (atm) eller millimeter kvicksilver (mmHg). Klicka här och ta reda på mer om detta ämne!
Kemi

Testa dina kunskaper och lär dig mer med den här listan över lösta övningar om kemiska balanser. Genom detta material kommer du att kunna bättre förstå hur man bearbetar jämviktskonstanter (Kp, Kc och Ki), jämviktsförskjutning, pH och pOH, samt jämvikt i så kallade buffertlösningar.