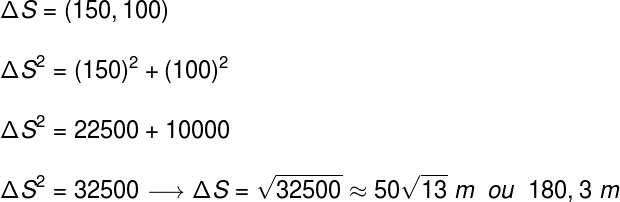geometrisk isomer är ett slags rymdisomerism som utvärderar och jämför positionen i rymden för liganderna hos två kolatomer i en kedja. Denna utvärdering görs från ett imaginärt plan mellan de inblandade kolerna.
Imaginärt plan som delar molekylen
Det imaginära planet i strukturen ovan delar molekylen i ett övre plan och ett nedre plan. Med detta kan vi utvärdera och jämföra de kolligander som är involverade i vart och ett av dessa plan. Se typerna av geometriska isomerer:
→ Cis-trans geometrisk isomer
En förening har cis-trans geometrisk isomerism när kedjan visar:
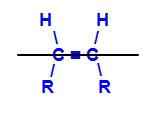
Öppen kedja med en dubbelbindning mellan två kol, som har samma länkar till varandra. Se ett exempel:
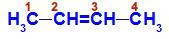
Strukturformel för But-2-en
I strukturen kan vi observera att både kol 2 och kol 3 har samma ligander, vilka är väte (H) och metyl (CH3).
Sluten kedja med två kol som har samma ligander till varandra. Se ett exempel:
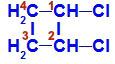
Strukturformel av 1,2-diklorcyklobutan
I strukturen kan vi observera att både kol 1 och kol 2 har samma ligander, vilka är väte (H) och klor (Cl).
För att förklara cis-trans-isomerism kommer vi att använda but-2-en:
a) Cis-isomer: är den geometriska isomeren i vilken samma ligander upptar samma plan. I exemplet nedan är vätena i samma plan, liksom metylradikalerna.

Strukturformel för cis-but-2-en
b) Trans-isomer: är den geometriska isomeren där olika ligander upptar samma plan. I exemplet nedan har vi i samma plan ett väte och en metyl (CH3).
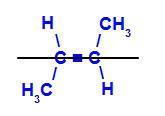
Strukturformel för trans but-2-en
Sluta inte nu... Det finns mer efter reklam;)
→ E-Z geometrisk isomer
En förening har E-Z geometrisk isomerism när kedjan har:
Öppen kedja med en dubbelbindning mellan två kol, som har alla eller några olika länkar. Se ett exempel:
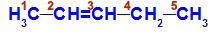
Strukturformel för pent-2-en
I strukturen kan vi se att kol 2 har metylliganden (CH3och väte (H) och kol 3 har väte (H) och etyl (H) ligand3C-CH2).
Sluten kedja med två kol som har alla eller några olika ligander. Se ett exempel:
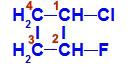
Strukturformel av 1-klor-2-fluor-cyklobutan
I strukturen kan vi observera att kol 1 har väte och klor som huvudligander och kol 2 har väte och fluor som huvudligander.
NOTERA: Bland de olika liganderna, i geometrisk isomerism, utvärderar vi ligandens komplexitet (antal atomer) eller atomnummer.
För att förklara E-Z-isomeren kommer vi att använda både pent-2-en och 1-klor-2-fluor-cyklobutan:
a) E-isomer
geometrisk isomer där de mer komplexa liganderna eller de med det högsta atomnummeret är placerade på motsatta plan. I följande exempel är den mest komplexa liganden på kol 2 metyl och den mest komplexa liganden på kol 3 är etyl, som är placerade i olika plan.
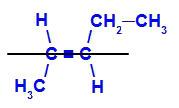
Strukturformel för E-pent-2-en
b) Isomer Z
geometrisk isomer där de mer komplexa liganderna eller de med det högsta atomnummeret är placerade på samma plan. I följande exempel är den högsta atomenummerliganden för kol 1 klor (Z = 17), och den högsta atomenummerliganden för kol 2 är fluor (Z = 9), som är placerade i samma plan.
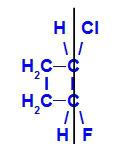
Strukturformel för Z-1-klor-2-fluor-cyklobutan
Av mig Diogo Lopes Dias
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
DAGAR, Diogo Lopes. "Vad är geometrisk isomerism?"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria-geometrica.htm. Åtkomst den 28 juni 2021.
Kemi
Vet vad de olika typerna av plana och rumsliga isomerer handlar om, såsom funktion, position, kedja, tautomerism, metamerism, cis-trans geometrisk och optisk isomerism.