DE aktiverings energi det är den minsta mängd energi som krävs för att kollisionen mellan reaktantpartiklarna, gjord i en gynnsam orientering, ska äga rum och resultera i en reaktion.
Reaktioner inträffar endast när reaktanterna har aktiveringsenergi (eller den minimala energi som behövs, vilket varierar från reaktion till reaktion; antingen i kvantitet eller form) eller när den levereras till dem.
Till exempel, när metalliskt natrium kommer i kontakt med vatten, reagerar det våldsamt. Detta innebär att energiinnehållet i dessa reaktanter redan är tillräckligt för att reaktionen ska äga rum.
Om du sätter på en spis kommer förbränningsreaktionen endast att ske om vi placerar en tänd tändsticka eller någon annan eldkälla nära gasen som släpps ut av kaminen. Detta innebär att det i detta fall var nödvändigt att leverera energi till systemet så att det nådde aktiveringsenergin och reaktionen ägde rum.
När det gäller fosfor som används, för att den ska förbrännas, tillhandahålls aktiveringsenergin genom friktion. Detsamma händer med tändare, som också behöver en gnista som ger nödvändig aktiveringsenergi för förbränningen av gasen som finns i dem.
Aktiveringsenergi kan också tillhandahållas av ljus, vilket är fallet med sönderdelning av väteperoxid. Därför lagras den i mörka eller ogenomskinliga flaskor.

Således kan vi dra slutsatsen att aktiveringsenergin (E.fram tills) är skillnaden mellan den energi som behövs för att reaktionen ska starta (E) och den energi som finns i reaktanterna (E.pr):

Aktiveringsenergi är ett hinder för att reaktionen ska ske och det behövs för att bryta reaktanternas bindningar. Med detta sker reaktionen och nya anslutningar görs för att bilda produkterna.
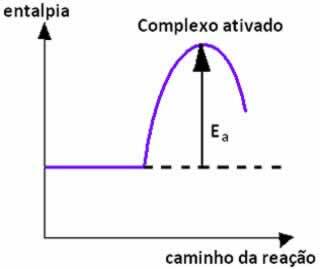
När kollisionen mellan partiklar av reaktanter med gynnsam orientering sker med lika energi eller högre än aktiveringsenergin, innan bildandet av produkterna bildas ett mellanliggande och instabilt tillstånd, denominerade aktiverat komplex, där reaktantbindningarna försvagas och produktbindningarna bildas. Således, aktiveringsenergi är den energi som behövs för att bilda det aktiverade komplexet.
Nedan har vi en graf som visar aktiveringsenergin som en barriär för att reaktionen ska ske:
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/energia-ativacao.htm
