För att en kemisk reaktion ska inträffa är det nödvändigt att uppfylla fyra grundläggande villkor, vilka är:
1. Reagens måste kontakta;
2. Det måste finnas kemisk affinitet mellan reagenserna;
3. Kollisioner mellan reagenspartiklar måste vara effektiva;
4. Aktiveringsenergi måste uppnås.
Se varje fall kort:
1.Kontakt mellan reagenser:
Detta tillstånd är uppenbart, för även om reaktanterna har mycket affinitet med varandra, som i fallet med syror och baser, kommer reaktionen inte att ske om de separeras. De måste ta kontakt så att deras partiklar kan kollidera, bryta bindningarna för reaktanterna och bilda bindningarna för produkterna.

2.Kemisk affinitet:
Som vi har sett är det nödvändigt att ta reagenserna i kontakt, men inte tillräckligt. Om vi till exempel sätter natrium i kontakt med vatten, kommer en extremt våldsam reaktion att inträffa, men om vi lägger guld ser vi ingen skillnad. Detta beror på att olika ämnen har olika kemiska affiniteter med varandra, eller kanske inte har någon affinitet alls. Ju större kemisk affinitet, desto snabbare blir reaktionen.
I de nämnda exemplen har natrium en stor affinitet med vatten, så mycket att för att inte komma i kontakt med fukten i luften lagras metalliskt natrium i fotogen. Guld är inert, varför guldmonument håller så länge, som sarkofagen i Egypten.

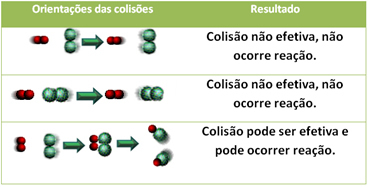
3.Kollisionsteori:
Även för föreningar som har kemisk affinitet är det nödvändigt att deras partiklar, atomer eller molekyler kolliderar effektivt för att reaktionen ska kunna ske. Inte alla partiklar som kolliderar gör detta effektivt, men chocker som leder till att de bryts reagensbindningar och bildning av nya bindningar är de som sker i rätt orientering och med energin tillräckligt.
Nedan visas fallet med två ineffektiva kollisioner och en effektiv kollision som resulterar i att reaktionen inträffar.
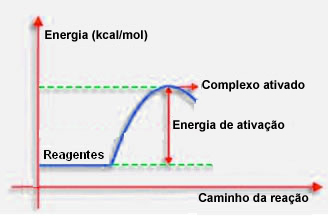
4.Aktiveringsenergi och aktiverat komplex:
Som nämnts i föregående punkt behöver effektiv kollision, förutom gynnsam vägledning, också tillräckligt med energi. Den minsta mängd energi som behövs för att varje reaktion ska äga rum kallas aktiveringsenergin.
Om reaktanterna har en energi som är lika med eller större än aktiveringsenergin, under den välorienterade chocken, ett initialt aktiverat komplex kommer att bildas, vilket är en mellanstruktur mellan reaktanterna och Produkter. I det aktiverade komplexet finns det försvagade reagensbindningar och nya produktbindningar bildas.
Således fungerar aktiveringsenergin som ett slags barriär för att reaktionen ska inträffa, för ju större den är, desto svårare blir det för reaktionen att inträffa. I vissa fall är det nödvändigt att leverera energi till reagensen. Till exempel har kokgas en affinitet att interagera med syre i luften, men vi måste leverera energi när vi sammanför matchningen, annars sker inte reaktionen. Men när den väl börjat släpper reaktionen ut tillräckligt med energi för att aktivera de andra molekylerna och hålla reaktionen igång.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm

