I studien av termologi kallar vi det adiabatiska omvandlingar de gasformiga transformationerna där det inte finns något värmeväxling med den yttre miljön. Därför är värmen noll vid den adiabatiska omvandlingen.
Q = 0
Om vi tillämpar termodynamikens första lag har vi:
Q = ∆U + τ
∆U = - τ
Men vad betyder det att det inte finns något värmeväxling mellan den yttre miljön? Det betyder att om en gasutvidgning inträffar och gasen utför ett jobb på 300 J så gör det inte om det sker värmeväxling med mediet kommer variationen av gasens inre energi att vara negativ, därför vi kommer att ha:
∆U = - 300 J
Om det nu sker en minskning av gasens inre energi kan vi säga att det också var en minskning av gastemperaturen. Från den allmänna gaslagstiftningen

vi kan säga att om volymen ökar och gastemperaturen sjunker kommer gastrycket nödvändigtvis också att minska. Generellt sett kan vi säga att detsamma händer med kompression, för om det finns kompression kommer gasens inre energi att öka, så trycket kommer också att öka.
Mind Map: Adiabatic Transformation
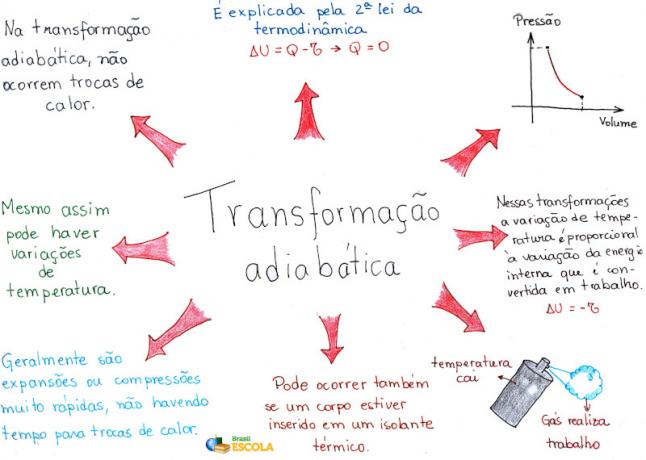
* För att ladda ner mind map i PDF, Klicka här!
Kort sagt kan vi säga att:
- vid adiabatisk expansion minskar temperatur och tryck;
- vid adiabatisk kompression ökar både temperatur och tryck.
Diagrammet nedan ger oss en översikt över den adiabatiska omvandlingen:
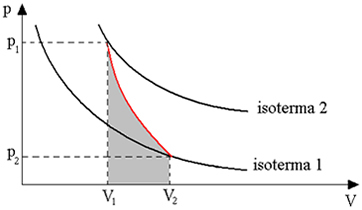
Adiabatiska transformationer erhålls med hjälp av värmeisolerade behållare eller också genom kompression eller mycket snabb expansion.
Således kan vi dra slutsatsen att när en gas utbyter värme med den yttre miljön, tar det lite tid för värmen att fortplantas genom gasmassan och för att den kommer i jämvikt. Därför, när både expansion och snabb kompression utförs, sker det praktiskt taget inget värmeväxling med den yttre miljön.
* Mind Map av mig. Rafael Helerbrock
Av Domitiano Marques
Examen i fysik
Källa: Brazil School - https://brasilescola.uol.com.br/fisica/estudo-transformacao-adiabatica.htm
